8 Minute
Sună ca un paradox: o boală care distruge vieți ar putea transporta molecule care încetinesc o altă afecțiune devastatoare. Totuși, lucrări recente de laborator pe șoareci indică exact această posibilitate, iar explicația stă într‑o proteină mică și în „echipa de curățenie” a creierului.
Tiparul neașteptat între două diagnostice sumbre
Clinicienii și epidemiologii au observat de mult un semn ciudat: persoanele diagnosticate cu cancer au, în medie, o probabilitate mai mică de a primi ulterior un diagnostic de boală Alzheimer, iar cei cu Alzheimer par mai puțin predispuși să dezvolte cancer. Corelația nu este cauzalitate. Totuși, când un pattern persistă în studii populaționale ample, merită o explicație mecanistică riguroasă.
Boala Alzheimer este, în mod clasic, asociată cu proteina amiloid‑beta, care se pliază greșit și agregă în plăci lipicioase între neuroni. Aceste plăci perturbă semnalizarea nervoasă, declanșează inflamație cronică și contribuie la declin cognitiv progresiv. În creiere sănătoase, celulele imune denumite microglia patrulează țesutul și îndepărtează resturile, dar în Alzheimer aceste celule deseori nu reușesc să elimine eficient proteinele pliate anormal, permițând acumularea de plăci.
Ce au arătat experimentele pe șoareci
Cercetătorii au implantat țesut tumoral uman — prelevat din cancere de plămân, prostată și colon — sub pielea șoarecilor modificați genetic care, în mod obișnuit, dezvoltă plăci dense de amiloid‑beta pe măsură ce îmbătrânesc. Rezultatul a fost izbitor. Șoarecii purtători de tumori au prezentat mult mai puțină acumulare de plăci în creier decât omologii lor fără tumori. În mai multe teste, șoarecii cu tumori au performat și mai bine la sarcini de memorie, sugerând că schimbarea avea consecințe funcționale, nu doar semnătură microscopică.
Urmărirea semnalului a condus echipa la cistatină‑C, o proteină mică, secretată, abundentă în probele de sânge de la tumori. Dovezile din experimente sugerează că cistatina‑C produsă de tumori intră în circulație, traversează bariera hematoencefalică — frontiera selectivă endotelială care în mod normal restricționează multe molecule transportate prin sânge — și ajunge în parenchimul cerebral.
Odată ajunsă în creier, cistatina‑C pare să se lege de agregatele incipiente de amiloid‑beta și să acționeze ca o etichetă. Acea etichetă pare să angajeze microglia printr‑un receptor cunoscut sub numele Trem2, schimbând aceste celule imune într‑un fenotip mai activ, capabil să elimine plăcile. Pe scurt: tumorile exportau o moleculă care le‑a permis microgliilor să își facă mai bine „meseria”.
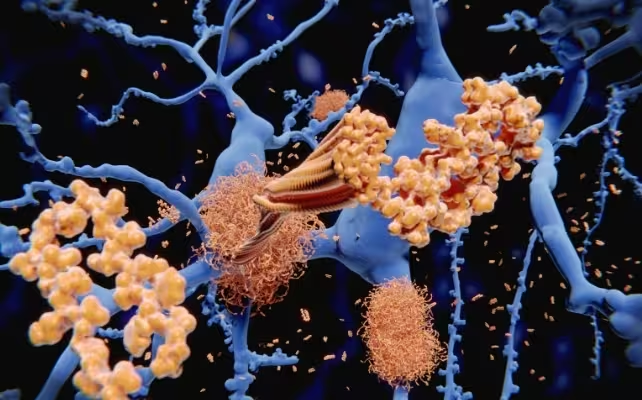
Aglomerările de amiloid‑beta declanșează inflamație și leziuni în țesutul cerebral.
Biologia compromisurilor
La prima vedere, ideea că un cancer ar putea conferi un efect protectiv creierului pare contraintuitivă. Dar biologia evolutivă și moleculară abundă în compromisuri: căile care favorizează supraviețuirea și creșterea celulară într‑un context pot fi dăunătoare în altul. Metabolismul și secretomul unei tumori — mixul de proteine secretate — reflectă impulsul ei de a crește și de a ocoli controalele locale. Uneori, acești factori secretați au efecte off‑target în alte părți ale corpului, fie în bine, fie în rău.
Aici, cistatina‑C arată ca un produs secundar al biologiei tumorale care, întâmplător, ajută microgliile să recunoască și să elimine sămânța de amiloid. Asta nu înseamnă că cancerul este de dorit. Daunele provocate de malignitate depășesc cu mult orice beneficiu incidental. Dar identificarea proteinei și a mecanismului ei creează o oportunitate: am putea imita acțiunea benefică a cistatin‑C fără a declanșa o tumoare?
Implicații și posibilități terapeutice
Există mai multe căi tranziționale plauzibile. Una ar fi proiectarea unor forme inginerizate de cistatin‑C care se leagă de amiloid‑beta mai puternic sau care persistă mai mult în creier. Alta ar fi dezvoltarea de molecule mici sau biologice care activează selectiv Trem2 și împing microgliile către un stadiu care curăță plăcile. Abordările de terapie genică pot fi, de asemenea, imaginabile, deși ele vin cu obstacole de reglementare și siguranță mai mari.
Fiecare direcție necesită un echilibru atent. Activarea microglială poate fi o sabie cu două tăișuri: prea puțină activare și plăcile persistă; prea multă și inflamația rezultată poate răni neuroni. Orice terapie ar trebui să împingă răspunsul imunitar spre un program productiv, nu distructiv. Asta implică optimizarea dozei, a duratei tratamentului și a țintelor moleculare secundare care ameliorează inflamația excesivă.
Un alt aspect tehnic important este modul în care o moleculă exogenă ajunge și rămâne în creier. Bariera hematoencefalică umană are proprietăți diferite față de cea a șoarecilor, iar transportul transendotelial poate necesita modificări (de exemplu, vectori de livrare sau fragmente de proteine) pentru a asigura penetrarea și stabilitatea fără a compromite integritatea vasculară.
Cât despre selecția pacienților, terapiile viitoare ar putea necesita biomarkeri specifici: niveluri de cistatin‑C în lichidul cefalorahidian (LCR), semnături transcriptomice ale microgliilor sau imagistică moleculară care indică activarea Trem2. Identificarea unor astfel de biomarkeri ar spori siguranța și eficacitatea studiilor clinice prin stratificarea persoanelor care sunt cel mai probabil să răspundă pozitiv.
Este esențial să reținem avertismentul că aceste descoperiri provin din modele animale, nu din oameni. Modelele de șoareci reproduc aspecte ale Alzheimer — în special depozitele de amiloid —, dar nu capturează pe deplin peisajul clinic și patologic al demenței umane. Rămâne neclar dacă tumorile umane produc cistatin‑C în cantități suficiente sau dacă dinamica barierei hematoencefalice umane permite același transfer observat la șoareci. Studii pe scară largă la om și trialuri clinice atent concepute ar fi necesare înainte ca orice terapie bazată pe cistatin‑C să poată fi luată în considerare.

Descoperirea deschide posibilități intrigante pentru tratamentele Alzheimer.
Perspective ale experților
„Această lucrare ne oferă o legătură moleculară tangibilă între două boli care au fost observate mult timp ca fiind opuse una alteia în datele populaționale,” spune Dr. Maria Langford, neuroimunolog la Institutul Albion pentru Cercetarea Creierului. „Acea legătură — cistatin‑C care interacționează cu Trem2 microglial — oferă o țintă realistă. Provocarea acum este să transformăm un fenomen condus de tumori într‑o terapie sigură, controlată, care să amplifice clearance‑ul fără a declanșa inflamație dăunătoare.”
Dr. Langford subliniază prudența. „Modelele pe șoareci sunt indispensabile pentru înțelegerea mecanismelor, dar biologia umană este mai complicată. Avem nevoie de biomarkeri care să ne spună când microgliile fac un clearing util versus când provoacă daune colaterale. Acea precizie va determina dacă abordarea este fezabilă.”
Context mai larg și pași următori
Studiul se încadrează într‑o recunoaștere tot mai mare că sănătatea sistemică influențează neurodegenerarea. Fluxul sanguin nu este doar un conduct pentru nutrienți și hormoni; el transportă semnale ale sistemului imunitar, ale microbiomului intestinal, ale organelor metabolice și, după cum sugerează această lucrare, ale tumorilor. Terapiile care manipulează factorii sistemici — fie proteine, lipide sau modulatori imuni — pot oferi abordări complementare strategiilor care vizează direct amiloidul.
Cercetătorii trebuie acum să răspundă la mai multe întrebări practice și științifice:
- Oamenii cu anumite tipuri de tumori prezintă modificări măsurabile ale nivelurilor de cistatin‑C în lichidul cefalorahidian?
- Poate o cistatin‑C inginerizată să traverseze în siguranță bariera hematoencefalică la om și să păstreze funcționalitatea de etichetare a amiloidului?
- Care este fereastra de dozare care evită supra‑stimularea microgliilor și inflamația secundară?
- Ce biomarkeri de siguranță și eficacitate sunt cei mai relevanți pentru trialurile clinice?
Acestea sunt întrebări tratabile, dar ele cer studii pas cu pas, în medii clinice controlate, cu comitete de etică și monitorizare atentă. În paralel, studiile epidemiologice pot fi rafinate pentru a controla variabilele confuzive (de exemplu, tipuri de tratament oncologic, vârsta, comorbidități) și pentru a evalua reproducibilitatea asocierii inversate între cancer și Alzheimer la nivel populațional.
Pentru pacienți și îngrijitori, în prezent rezultatul nu este un tratament, ci un memento că biologia poate ascunde conexiuni surprinzătoare. O proteină care ajută o tumoare să supraviețuiască ar putea, în anumite circumstanțe, să ajute creierul să elimine proteine toxice. Oamenii de știință învață să „citească” aceste semnale de comunicare între organe și, cu puțin noroc și multă rigurozitate, să le refolosească fără a importa boala.
Fie că cistatin‑C va deveni o țintă terapeutică, un biomarker sau o pârghie conceptuală pentru noi imunoterapii, studiul direcționează cercetarea spre o hartă mai bogată a felului în care organele comunică între ele — și cum înțelegerea acestor conversații ar putea proteja creierul aflat în proces de îmbătrânire.
Sursa: sciencealert


Lasă un Comentariu