10 Minute
Parazitul se ascunde la vedere. În interiorul creierelor șoarecilor infectați timp de săptămâni, Toxoplasma gondii nu stă pe loc; se diversifică. Cercetări noi arată că chisturile recuperate după 28 de zile conțin un amestec mai bogat de subtipuri parazitare decât cele observate în faza inițială, acută, a infecției.
Această fază timpurie este dinamică. În prima săptămână, paraziții trec într-un mod de creștere mai rapidă, o sprint care îi ajută să se răspândească. Dar povestea nu se termină cu o singură, clară predare a responsabilității. După acel vârf, mulți paraziți trec în forme cu creștere mai lentă, care par specializate pentru întreținerea chisturilor. Populația dintr-un chist seamănă mai mult cu un ecosistem decât cu o specie unică care trece prin etape fixe.
Studiu și implicații
Wilson și colegii susțin că viziunea clasică din manuale — o maturizare liniară, în trepte, de la o etapă uniformă la alta — nu mai corespunde datelor. Analiza lor, publicată în Nature Communications, trasează un proces de maturare mai complex în care strategii multiple de creștere coexistă și se schimbă în timp. Pe scurt: maturarea nu este o linie dreaptă.
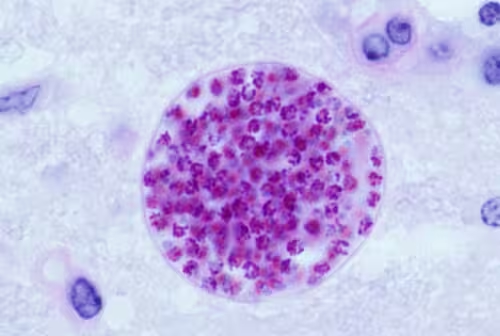
De ce contează asta? Pentru că biologia chisturilor stă la baza infecției cronice, a evaziunii imune și a potențialului de reactivare. Dacă chisturile găzduiesc tipuri diverse de paraziți, cu profile metabolice și de creștere diferite, terapiile proiectate pentru a viza o singură fază a ciclului pot pierde subpopulații importante. Vaccinurile și medicamentele care presupun un ciclu de viață rigid ar putea, prin urmare, să fie mai puțin eficiente decât se speră.
„Decenii la rând ciclul de viață a fost descris mult prea simplist," notează Wilson, „iar descoperirile noastre împing domeniul să-și actualizeze modelele." Cercetarea reframează modul în care oamenii de știință gândesc persistența în creier și sugerează direcții experimentale noi, îndreptate spre cartografierea diversității intra-chist și a vulnerabilităților acesteia.
Pe măsură ce cercetătorii refac harta fazelor ascunse ale Toxoplasma, începe vânătoarea de intervenții capabile să țină cont de — și să exploateze — acea diversitate.
Contextul biologic al chisturilor este fundamental pentru înțelegerea toxoplasmozei cronice. În modelele experimentale, subpopulațiile de paraziți cu ritm diferit de proliferare (tahizoite rapide versus bradizoite lente) interacționează nu doar cu țesutul gazdă, ci și între ele, afectând permeabilitatea chistului, compoziția peretelui chistic și modul în care sistemul imun local recunoaște sau ignoră agenții patogeni. Această heterogenitate este relevată de tehnici moderne — transcriptomică la nivel unicelular, imagistică avansată și analize metabolomice spațiale — care permit descompunerea populațiilor dintr-un singur chist în componente funcționale distincte.
Metodele folosite pentru a descrie această complexitate includ secvențierea ARN-ului la nivel unicelular (single-cell RNA-seq), care identifică profiluri de expresie diferite între paraziții din același chist; tehnici de urmărire a liniei celulare (lineage tracing), care pot arăta trasee de diferențiere și de tranziție între forme; și microscopia crio-electronică sau confocală cu rezoluție înaltă, ce oferă imagini spațiale ale arhitecturii chistului. Combinația acestor abordări oferă perspective asupra modului în care micro-niche-urile din chist pot favoriza anumite fenotipuri parazitare — de exemplu, cele axate pe stocarea energetică, rezistența la stres oxidativ sau reducerea activității metabolice pentru a evita detectarea imună.
O consecință practică a acestor descoperiri este reevaluarea strategiilor terapeutice. Tratamentele actuale pentru toxoplasmoză au fost dezvoltate în principal pentru a viza forma tachizoită, responsabilă pentru faza acută, rapid proliferativă. Dacă într-un chist coexistă bradizoite metabolice și alte subtipuri cu particularități biochimice, un singur compus farmacologic ar putea elimina doar o porțiune din populație, lăsând restul capabil să persiste și chiar să reinițieze o infecție activă la reimunodeprimare. Aceasta explică parțial de ce eradicarea completă a Toxoplasma în creier rămâne dificilă și de ce reactivarea — de exemplu, la pacienții HIV/SIDA sau la cei tratați cu imunosupresoare — continuă să fie o problemă clinică serioasă.
Din punct de vedere al sănătății publice, relevanța este clară: multe persoane sunt seropozitive pentru Toxoplasma gondii și pot păstra chisturi cerebrale pentru mulți ani. În majoritatea cazurilor aceste infecții sunt asimptomatice, dar riscul reactivării în context de imunosupresie face din înțelegerea și controlul biologiei chisturilor o prioritate pentru cercetare. Dezvoltarea unor terapii care să vizeze simultan mai multe stări metabolice, sau să exploateze vulnerabilități comune (de exemplu, căi metabolice esențiale prezente în toate subpopulațiile), ar putea crește șansele unui tratament curativ.
Un alt aspect remarcabil al noii perspective este impactul asupra designului vaccinurilor. Vaccinurile experimentale care induc răspunsuri imune împotriva antigenspecifice ale stadiilor rapide ar putea fi insuficiente dacă chisturile includ subpopulații care exprimă antigene distincte sau care sunt foarte puțin active metabolic și astfel mai puțin vizibile sistemului imun. Studii care urmăresc să identifice antigene comune sau să stimuleze un răspuns imunitar mai larg, inclusiv cel mediat de celulele T CD8+ și de răspunsurile imunitare înnăscute la nivelul microgliei, pot oferi căi mai robuste pentru prevenție și control.
Pe plan mecanistic, diferențierea intra-chistică ridică întrebări interesante: ce semnale micro-ambientale (nutrienți, oxigen, factori de stres) determină tranziția între fenotipurile parazitare? Care sunt regulile genetice și epigenetice care guvernează plasticitatea? În ce măsură diversitatea este generată de variabilitatea inițială a invadatorilor versus adaptări locale induse de mediul creierului gazdă? Răspunsurile la aceste întrebări vor necesita experimente care combină modele animale relevante, culturi ex vivo de țesut cerebral, și comunități interdisciplinare care reunesc biologi moleculari, imuniologi, farmaciști și bioinformaticieni.
Din perspectiva cercetării fundamentale, noile date susțin o schimbare conceptuală: în loc să considerăm stadiile ciclice (tahizoit → bradizoit) ca trepte discrete, e mai util să gândim în termeni de peisaje de stare, în care cumulul de fenotipuri este dependent de un set de parametri dinamici. Această abordare este compatibilă cu observațiile din alte organisme persistente, cum ar fi bacteriile în stare latentă sau protozoarele care adoptă stări quiescente pentru a supraviețui tratamentelor.
Realizarea unei hărți funcționale a populațiilor intra-chist ar necesita standardizarea protocoalelor pentru izolarea chisturilor, metode sensibile pentru cuantificarea subtipurilor și criterii reproducibile pentru clasificare. De asemenea, va fi importantă includerea unor modele umane relevate, cum ar fi organoidele cerebrale sau mostre clinice acolo unde este posibil și etic. Această tranziție de la modele murine la sisteme care reflectă mai fidel biologia umană va permite evaluarea translațională a strategiilor terapeutice propuse.
Tehnic, există și provocări: chisturile sunt mici, rare și integrate în țesutul cerebral, ceea ce compliquează izolarea intactă și analiza la nivel unicelular. Mai mult, paraziții din chist pot fi în concentrații scăzute, impunând metode sensibile de amplificare și control riguros al contaminării cu ARN gazdă. Totuși, progresele recente în microdisecție, sortare celulară și tehnici de amplificare au făcut posibile analize care erau de neconceput acum un deceniu.
Pe plan terapeutic, idei emergente includ utilizarea terapiilor combinate: agenți care perturbă global metabolismul parazitar, plus compuși specifici care atacă subpopulații rezistente; sau strategii de „decongelare” a bradizoitelor lente, forțându-le într-o stare mai sensibilă la tratament, urmate de administrarea unui agent tranchilizant sau letal. Alte abordări pot exploata sistemul imunitar, de exemplu prin stimularea răspunsurilor antivirale/antiparazitare locale sau prin transplant celular imunomodulator pentru a reconstitui un micro-mediu capabil să elimine chisturile.
Există și oportunități pentru diagnostic: detectarea biomarkerilor specifici ai diversității intra-chist, în fluide accesibile (ser, lichid cefalorahidian), ar putea ajuta la stratificarea riscului de reactivare și la monitorizarea răspunsului la terapie. Biomarkerii pot include fragmente de ARN parazitar, metaboliți specifici sau semnale imunologice asociate prezenței subpopulațiilor tolerogene.
În concluzie, descoperirile recente referitoare la diversitatea Toxoplasma gondii din chisturile cerebrale schimbă paradigma: în loc de etape discrete, avem populații dinamice, heterogene, care solicită abordări terapeutice și preventive mai sofisticate. Această schimbare are implicații pentru designul medicamentelor, dezvoltarea vaccinurilor, strategiile de diagnostic și pentru prioritizarea cercetărilor care pot transforma aceste cunoștințe în instrumente clinice.
Pe termen lung, un plan de cercetare integrat ar trebui să includă:
- cartografierea spațială a expresiei genice și metabolice în chisturi; - validarea vulnerabilităților comune prin ecrane CRISPR și teste farmacologice; - dezvoltarea de modele umane complementare pentru validare translatională; - proiectarea de strategii terapeutice combinate și de vaccinuri cu spectru larg; - monitorizarea clinică a biomarkerilor pentru a ghida decizii terapeutice.
Actualizarea modelelor conceptuale despre viața intracelulară a Toxoplasma gondii nu este doar o provocare academică, ci un pas esențial pentru a reduce povara clinică a toxoplasmozei, mai ales la persoanele vulnerabile. Pe măsură ce tehnologiile devin mai sensibile și interdisciplinaritatea crește, avem șansa reală de a identifica intervenții care pot preveni reactivarea și pot conduce, într-un final, la terapii care reduc sau chiar elimină chisturile din țesutul cerebral.
Aceste progrese vor necesita colaborare strânsă între laboratoare fundamentale și clinice, investiții în infrastructură experimentală și un angajament de a testa ipotezele generate în modele cât mai relevante pentru biologia umană. În fața unei amenințări persistente precum Toxoplasma gondii, adaptarea strategiei științifice la complexitatea reală a organismului parazitar este o condiție necesară pentru succesul terapeutic.
Sursa: sciencealert

Lasă un Comentariu