10 Minute
Cercetătorii de la University of Massachusetts Amherst raportează un vaccin bazat pe nanoparticule care a prevenit apariția mai multor tipuri de tumori la șoareci pe parcursul întregii perioade a studiului, de 250 de zile. Formula experimentală combină antigene specifice cancerului cu un adjuvant puternic, denumit „super” adjuvant, pentru a instrui sistemul imunitar să recunoască și să distrugă celulele tumorale înainte ca acestea să poată prolifera și să formeze tumori detectabile. Această abordare se încadrează în tendința tot mai evidentă de a folosi nanoparticule și strategii multi-adjuvant în imunoterapie și vaccinologie oncologică.
Modul în care vaccinul antrenează sistemul imunitar
Vaccinul folosește nanoparticule lipidice pentru a prezenta porțiuni recunoscute ale celulelor canceroase sub forma unor antigene — etichete moleculare care semnalează un pericol pentru celulele imune. Antigenele sunt încapsulate împreună cu ceea ce autorii numesc un super adjuvant: două stimulente imune livrate simultan în interiorul nanoparticulelor pentru a amplifica atât spectrul, cât și intensitatea răspunsului imunitar. Prin această combinație, formula acționează ca un program de antrenament pentru sistemul imunitar, educând celulele imune — în special celulele prezentatoare de antigen, cum sunt celulele dendritice, și limfocitele T citotoxice (CD8+) — să recunoască semnături moleculare asociate tumorii și să atace tumorile aflate în fază incipientă.
Din punct de vedere mecanistic, nanoparticulele lipidice optimizează livrarea antigenelor și adjuvanților către aceleași compartimente celulare și către aceiași celule prezentatoare de antigen, ceea ce favorizează procesarea antigenului și activarea robustă a limfocitelor T helper (CD4+) și T citotoxice. Activarea multiplă a căilor imune — incluzând PRR (pattern recognition receptors), semnalizarea prin TLR (Toll-like receptors) și stimularea co-stimulatoare — crește probabilitatea generării unei memorii imunitare Durabile (memorie T centrală și memoria T efectoare) care poate supraveghea și elimina celulele tumorale apărute ulterior.
De ce nanoparticule?
Nanoparticulele sunt vehicule de livrare foarte mici care protejează molecule fragile, permit controlul eliberării și direcționează componentele către aceleași celule imune în același timp. Ambalând antigenele și adjuvanții împreună, vaccinul angajează simultan mai multe căi imune, ceea ce produce o reacție coordonată și mai durabilă decât multe formulări cu un singur component. În plus, nanoparticulele lipidice permit stabilizarea antigenelor sensibile la degradare, pot reduce efectele sistemice nedorite prin eliberare țintită și pot fi proiectate pentru a favoriza absorbția de către ganglionii limfatici, unde inițierea răspunsului adaptativ se realizează cel mai eficient.
Pe plan tehnic, designul nanoparticulelor include optimizări ale mărimii, încărcăturii superficiale și compoziției lipidice pentru a echilibra stabilitatea, biocompatibilitatea și eficiența de livrare. De exemplu, nanoparticulele foarte mici pot circula diferit și pot fi captate altfel de către diferite subtipuri de celule imune comparativ cu particulele mai mari; prin optimizarea acestor parametri se poate obține o țintire mai precisă către celulele dendritice și macrofagele din nodurile limfatice. Materialele folosite sunt în general alese pentru a fi biodegradabile și compatibile cu standardele de fabricație, având în vedere perspectivele de translație clinică.
Rezultate: supraviețuire, protecție încrucișată și durabilitate
În prima serie de experimente, cercetătorii au încărcat nanoparticulele cu peptide specifice melanomului și au vaccinat șoarecii înainte de a-i expune, la câteva săptămâni după vaccinare, la celule de melanom. Rezultatul a fost remarcabil: 80% dintre șoarecii vaccinați au supraviețuit și au rămas fără tumori pentru întreaga durată de observare de 250 de zile. În contrast, martorii nevaccinați și animalele cărora li s-au administrat formulări alternative au dezvoltat tumori și au murit în termen de șapte săptămâni. Această diferență dramatică sugerează o eficiență substanțială a formulării cu nanoparticule în prevenirea inițierii și progresiei tumorale în acest model preclinic.
Pentru a evalua protecția mai largă, echipa a testat și o strategie bazată pe lizate tumorale — un antigen general compus din celule tumorale distruse mecanic sau chimic, care conține un amestec complex de proteine tumorale și neoantigene. Șoarecii vaccinați cu această formulare pe bază de lizat au fost supuși unui provocări cu trei tipuri diferite de cancer: melanom, cancer pancreatic și cancer mamar triplu-negativ. Ratele de protecție au variat în funcție de tipul tumoral, dar au fost semnificative: 88% fără tumori în modelul pancreatic, 75% pentru cancerul mamar triplu-negativ și 69% pentru melanom. Aceste date indică un grad important de protecție încrucișată, sugerând că utilizarea unui antigen complex (lizat) poate pregăti sistemul imunitar pentru a recunoaște un spectru larg de antigene tumorale, nu doar un singur epitope specific.
Următoarele teste au încercat să imite diseminarea tumorală și au arătat că fiecare animal supraviețuitor a rămas fără tumori detectabile, ceea ce sugerează existența unui efect de memorie imună durabil. Memoria imună robustă este esențială pentru prevenirea reapariției tumorii: celulele T cu memorie pot răspunde rapid la reapariția antigenului și pot neutraliza celulele tumorale înainte ca acestea să se extindă. Autori precum Prabhani Atukorale, inginer biomedical la UMass Amherst, subliniază că „prin proiectarea acestor nanoparticule pentru a activa sistemul imunitar prin activarea multiplă a căilor, combinată cu antigene specifice cancerului, putem preveni creșterea tumorilor cu rate de supraviețuire remarcabile”.
Analizele suplimentare din studiu au inclus măsurători ale răspunsurilor celulare și umorale: s-au observat niveluri crescute de limfocite T CD8+ specific-tumorale, creșteri ale citokinelor pro-inflamatorii la momentul inițial al activării și prezența unor populații de limfocite T de memorie care au persistat pe termen lung. Astfel de marcaje imune oferă dovezi moleculare și celulare care susțin fenotipul clinic observat — adică supraviețuire crescută și absența tumorilor.
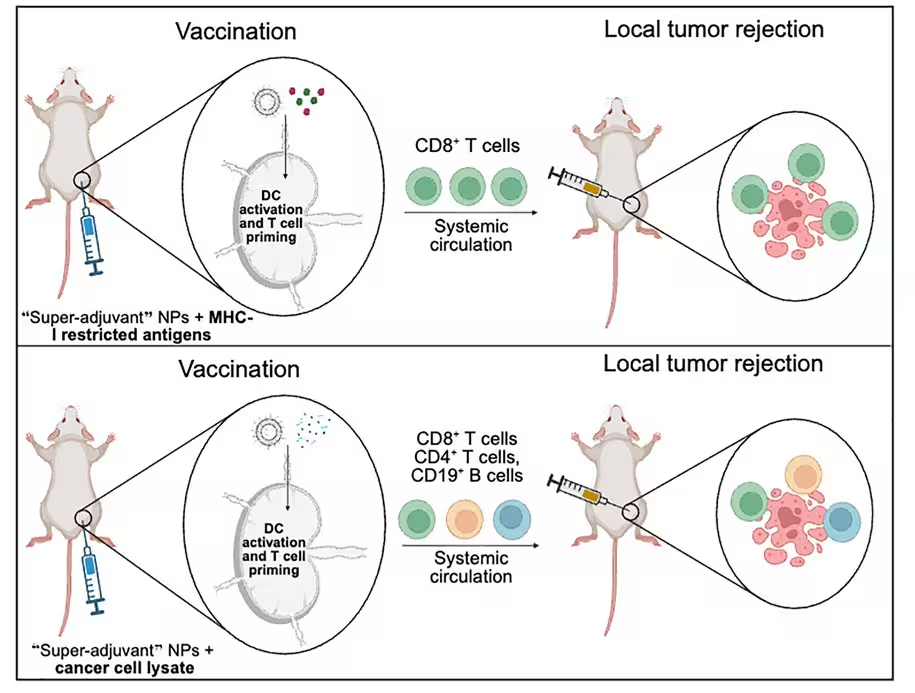
Un rezumat grafic al modului în care funcționează vaccinul împotriva cancerului. (Kane et al., Cell Rep. Med. 2025)
Pe lângă datele asupra supraviețuirii, autorii au efectuat experimente pentru a evalua siguranța preclinică: monitorizarea greutății, analiza histopatologică a organelor și măsurătorile markerilor inflamatori sistemici. În majoritatea cazurilor, nu s-au observat semne majore de toxicitate acută asociată administrării vaccinului la dozele folosite, dar autorii subliniază că evaluări toxice mai aprofundate sunt necesare înainte de orice trecere în faze clinice. Raportul indică faptul că echilibrul dintre eficacitate și tolerabilitate poate fi optimizat prin ajustarea dozelor, a raportului dintre antigen și adjuvant și a regimului de administrare.
Implicații, limite și pașii următori
Rezultatele, publicate în Cell Reports Medicine, indică o platformă flexibilă care ar putea fi adaptată pentru a ținti diferite tipuri de cancere sau utilizată profilactic la pacienții cu risc crescut. Utilizarea lizatului tumoral sugerează o abordare aproape universală, în care un singur vaccin ar putea pregăti imunitatea împotriva unui spectru larg de antigene tumorale, spre deosebire de strategii care se concentrează pe o singură mutație sau pe un singur peptid. Această versatilitate ar putea fi utilă în contextul heterogenității tumorale și al variațiilor între pacienți.
Totuși, autorii subliniază o limitare majoră: toate experimentele au fost efectuate pe modele murine. Modelele animale sunt indispensabile pentru testarea în stadii incipiente, dar nu garantează siguranța sau eficacitatea în om. Tranziția de la șoareci la oameni implică numeroase provocări: diferențe în sistemul imunitar, în microambientul tumoral, în răspunsurile la adjuvanți și riscul de reacții imune exagerate sau autoimunitate. În plus, eficacitatea observată în modele transplantabile de tumori poate să nu reflecte pe deplin performanța într-un context de tumori spontane sau în prezența unui microambient imunosupresiv complex.
Înainte de orice aplicație clinică, vaccinul va necesita evaluări preclinice extinse de siguranță (toxicologie acută și cronică), optimizarea dozelor și a raportului antigen/adjuvant, studii de farmacocinetică și biodistribuție, precum și producție conform standardelor GMP pentru materialele folosite. După aceste etape, trebuie proiectate studii clinice de fază I pentru a evalua tolerabilitatea, dozarea și semne timpurii de imunogenicitate la voluntari sănătoși sau la grupuri selectate de pacienți cu risc înalt. Etapele ulterioare (faze II/III) vor trebui să demonstreze, prin studii controlate, că vaccinul oferă protecție reală împotriva apariției sau recurenței tumorilor în populații umane.
- Context științific: livrarea prin nanoparticule și strategiile multi-adjuvant reprezintă o tendință în creștere în imunoterapie și dezvoltarea de vaccinuri oncologice.
- Descoperire cheie: prevenire puternică și durabilă a tumorilor în mai multe modele de cancer la șoareci timp de 250 de zile.
- Pași următori: teste de siguranță, ajustarea formulei și, eventual, studii clinice la om dacă datele preclinice susțin translația.
Dincolo de pașii reglementari, există considerații practice legate de fabricare și scalare: producția de lizate tumorale la scară clinică, standardizarea compoziției antigenice și asigurarea calității întregului lanț de fabricație vor necesita protocoale riguroase. Alternative la lizat, cum ar fi vaccinurile personalizate pe bază de neoantigene identificate prin secvențiere genomică, pot oferi specificitate crescută, dar cu costuri și complexitate logistică mai mari. Platforma cu nanoparticule ar putea, teoretic, să susțină ambele abordări: formulări standardizate pe bază de lizat pentru utilizare largă versus formulări personalizate pentru pacienți selecți.
De asemenea, integrarea unui astfel de vaccin în strategii terapeutice existente (chirurgie, radioterapie, chimioterapie, inhibitori ai punctelor de control imunologic) merită explorată. Vaccinurile preventive pot funcționa sinergic cu terapiile care reduc sarcina tumorală inițială sau care modifică microambientul tumoral pentru a permite un răspuns imunitar mai eficient. În același timp, riscul de efecte adverse imunosuprimate sau de exacerbări inflamatorii trebuie monitorizat îndeaproape.
Pe scurt, cercetarea extinde eforturile de a crea vaccinuri care nu doar tratează, ci și previn cancerul, oferind o foaie de parcurs potențială pentru viitoare strategii de imunoprevenție în oncologie. Pentru a transforma acest potențial într-o soluție clinică, pași riguroși de validare, optimizare și evaluare regulatoare sunt esențiali.
Sursa: sciencealert

Lasă un Comentariu