8 Minute
Reinterpretarea Alzheimer: o eroare imunitară în creier
Boala Alzheimer poate fi înțeleasă mai nuanțat dacă nu este văzută doar ca o proteinopatie, ci și ca o tulburare în care răspunsul imun propriu al creierului are un rol determinant. În această perspectivă emergentă, celulele imune din sistemul nervos central confundă componente neuronale cu agenți străini și declanșează o reacție defensivă prelungită, care slăbește treptat funcția neuronală și determină declin cognitiv. Pe termen lung, această activitate imună cronică produce pierderi progresive ale memoriei, ale capacității de raționament și ale funcțiilor zilnice — trăsăturile definitorii ale demenței.
Rolul dublu al beta-amiloidului
Un element cheie al acestei viziuni este rolul dual al beta-amiloidului. Studiat mult timp drept componenta centrală a plăcilor amiloide, beta-amiloidul pare să aibă și funcții antimicrobiene și de susținere a imunității înnăscute: poate neutraliza microorganisme și întări mecanismele defensive timpurii ale creierului. Această funcție protectorie sugerează că produsul biochimic nu este, în mod necesar, doar un reziduu patologic, ci și o componentă a răspunsului la agenți patogeni.
Problema apare atunci când beta-amiloidul se acumulează excesiv sau când reglementarea sa este perturbată. În aceste condiții, peptidele pot amplifica activarea imunitară și întreține un atac autoreactiv asupra țesutului cerebral. Un proces asemănător autoimunității ar putea explica de ce terapiile imunosupresoare sistemice clasice, precum corticosteroizii — eficiente în afecțiuni reumatologice — au demonstrat beneficii limitate în Alzheimer: microclimatul imun al creierului și mediatorii care îl controlează sunt specifici și diferă substanțial de cei periferici.
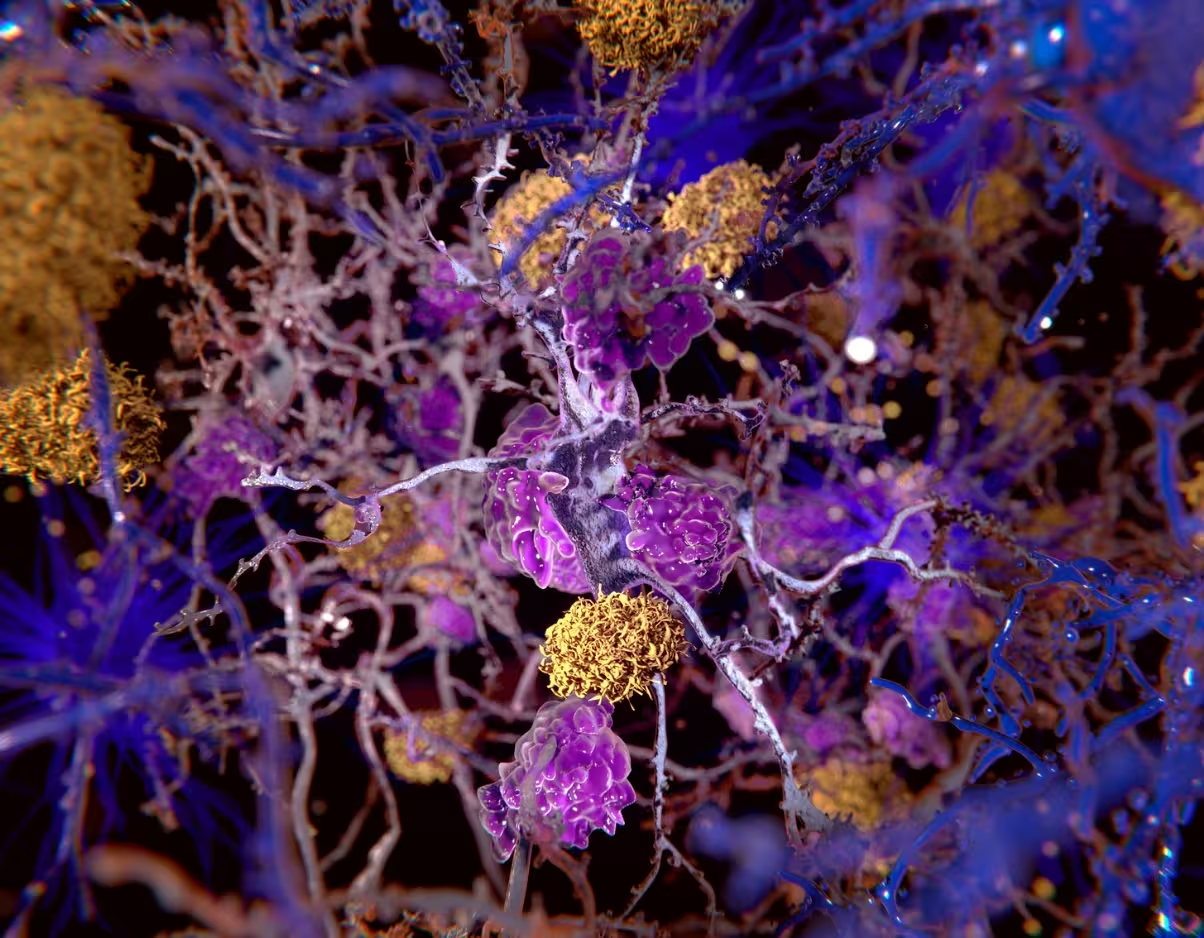
Ilustrație a plăcilor de beta-amiloid (galben) printre neuroni.
Context științific și ipoteze alternative
Cercetarea modernă se extinde dincolo de o explicație unică pentru boala Alzheimer. Există mai multe teorii concurente și complementare care încearcă să explice mecanismele de bază ale demenței:
- Disfuncția mitocondrială: Mitocondriile sunt centralele energetice celulare care transformă oxigenul și glucoza în energie utilizabilă sub formă de ATP. Dacă funcția mitocondrială este compromisă în neuroni, deficitul energetic rezultat afectează procesele sinaptice și procesele de memorie, facilitând neurodegenerarea. Disfuncția mitocondrială este corelată cu stresul oxidativ, acumularea de proteine defectuoase și scăderea capacității de reparare a neuronilor.
- Infecțiile cronice: Unii cercetători propun că infecțiile recurente sau persistente — inclusiv bacterii orale care migrează spre creier sau virusuri latente reactivate — pot declanșa cascade inflamatorii ce duc în timp la deteriorare neuronală și demență. Această ipoteză include mecanisme prin care patogenii stimulează producția de beta-amiloid ca mecanism antimicrobian, ceea ce poate evolua către inflamare nocivă în subpopulații susceptibile.
- Dezechilibre metalice: Manipularea anormală a metalelor esențiale, precum zincul, cuprul sau fierul, poate perturba biochimia neuronală și poate favoriza agregarea proteinelor toxice. Metaloproteinele și legarea metalelor la peptidele amiloidice pot modifica cinetica formării plăcilor și pot intensifica stresul oxidativ local.
Aceste teorii nu se exclud reciproc; dimpotrivă, sunt complementare. De exemplu, o infecție ar putea stimula producția de beta-amiloid ca răspuns protector, iar în funcție de predispoziția genetică, de starea barieră hematoencefalică și de capacitatea mitocondrială, acest răspuns protector poate degenera într-o inflamație cronică și dăunătoare.
Interacțiuni între ipoteze
Integrarea ipotezelor oferă o imagine multifactorială: predispoziții genetice (de exemplu, alele APOE), expuneri infecțioase, dezechilibre metalice și epuizare energetică converg pentru a modifica microambientul cerebral. Microglia — celulele imune rezidente din creier — pot rămâne activate pe termen lung, secretând citochine proinflamatorii și englobând fragmentar material neuronal, ceea ce duce la pierdere sinaptică. Astfel, boala Alzheimer poate fi conceptualizată ca o interacțiune între procese imunologice, metabolice și de gestionare a proteinei.
Implicații pentru tratament și cercetare
Dacă Alzheimer implică o direcționare greșită a imunității în sistemul nervos central, strategiile terapeutice trebuie proiectate pentru a viza căile imune specifice creierului. Aceasta impune o schimbare de paradigmă în dezvoltarea tratamentelor: nu doar blocarea acumulării de amiloid, ci modularea fină a răspunsului imun neurocentric.
Direcții terapeutice promițătoare
Direcțiile care au potențial includ:
- Modularea microgliei: Microglia sunt atât protecție, cât și potențial agresor. Intervențiile care readuc microglia la un fenotip de „curățare” sănătos, fără a activa cascada inflamatorie cronică, sunt foarte căutate. Studii preclinice vizează receptori microgliali specifici (de exemplu, TREM2) și semnale care reglează fagocitoza și secreția de citochine.
- Anti-inflamatoare penetrate în creier: Multe antiinflamatoare nu trec bariera hematoencefalică eficient sau au efecte sistemice nedorite. Molecule mici și anticorpi modifiați pentru a traversa bariera sau nanoparticule țintite ar putea atenua inflamația neuroinflamatorie fără supresie sistemică extensivă.
- Restabilirea dinamicii beta-amiloidului: Abordările trebuie să se concentreze nu doar pe eliminarea amiloidului, ci pe restabilirea echilibrului între rolurile protective antimicrobiene și potențialul patologic. Terapiile imuno-modulatoare care păstrează funcțiile antimicrobiene ale peptidei, în timp ce previn agregarea excesivă, sunt o direcție emergentă.
- Biomarkeri pentru diferențierea mecanismelor: Biomarkeri care pot distinge un răspuns antimicrobian legitim de o autoimunitate patologică vor fi critici pentru terapii de precizie. Acest lucru poate include analize de proteom, metabolom și semnături imune în lichidul cefalorahidian (LCR) sau imagistică moleculară avansată (PET pentru amiloid, microglia, sau inflamație).
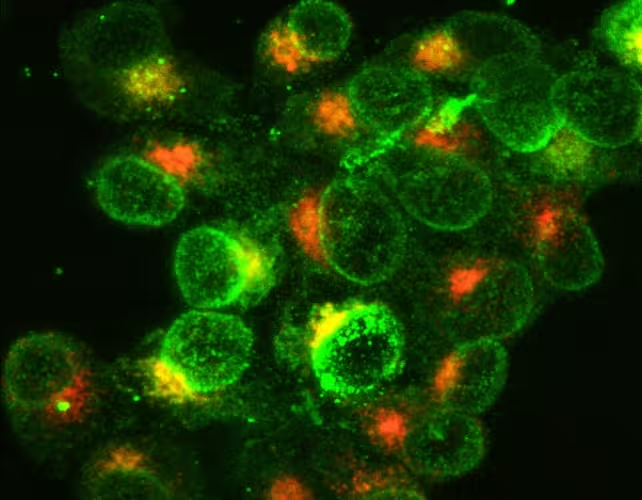
Celule albe ale sistemului imunitar activate pentru a lupta împotriva unei infecții bacteriene. Verdele indică molecule de la suprafață, iar portocaliul arată sinteza de molecule în interiorul celulelor.
Pe scara sănătății publice, impactul este uriaș: demența afectează peste 50 de milioane de persoane la nivel mondial, iar incidența continuă să crească odată cu îmbătrânirea populației. Pe lângă costul uman pentru pacienți și familiile lor, povara economică pentru sistemele de sănătate impune soluții inovatoare și fondate pe mecanisme biologice clare.
Provocări clinice și etice
Încercările terapeutice în Alzheimer se confruntă cu provocări majore: heterogenitatea cohortelor de pacienți, lipsa biomarkerilor predictivi universal valabili și riscurile asociate intervențiilor care modifică imunitatea cerebrală. Etic, intervențiile care suprimă sau reorientează sistemul imunitar trebuie evaluate atent pentru a nu crește vulnerabilitatea la infecții sau pentru a nu perturba funcții vitale de întreținere a țesutului nervos.
Priorități de cercetare și perspective viitoare
Progresul va necesita colaborare interdisciplinară care să îmbine neurologia, imunologia, boli infecțioase și chimia bioinorganicǎ. Printre prioritățile concrete se numără:
- Studii longitudinale mari, care urmăresc indivizi de la stadiile preclinice până la manifestarea demenței pentru a identifica cursuri ale bolii și markeri predictivi.
- Dezvoltarea agentilor imagistici care pătrund în creier și pot măsura în vivo inflamația microglială, acumularea de amiloid funcțional și activitatea metabolică.
- Trialuri terapeutice care manipulează semnalizarea neuroimună în mod specific, cu endpoint-uri care includ nu doar schimbări de placi amiloide, ci și funcție cognitivă, biodiversitate microglială și proteomica LCR.
- Studii de bioinorganicǎ care clarifică rolul metalelor esențiale în cinetica formării agregatelor și în activarea imunitară locală.
Fie că boala Alzheimer se dovedește în final a fi predominant autoimună, infecțioasă, metabolică sau un amestec complex al acestor mecanisme, reîncadrarea condiției în jurul reglementării imunitare deschide noi căi pentru diagnostic și tratament. Această abordare multidimensională poate identifica subgrupuri de pacienți care vor răspunde la strategii diferențiate — de exemplu, tratamente antimicrobiene în cazuri cu semnături infecțioase versus terapii imunomodulatoare în cazuri cu semnături autoimune.
Tehnologii și metode emergente
Tehnologiile care pot accelera descoperirea includ secvențierea unicelulară pentru a defini heterogenitatea microglială, modele organoide cerebrale care reproduc interacțiuni neuron-glia și platforme digitale de monitorizare cognitivă la domiciliu pentru detectare timpurie. De asemenea, studiile genetice (GWAS) și analizele multi-omice permit identificarea factorilor de risc și a țintelor moleculare noi.
Concluzie
Privind boala Alzheimer printr-o lentilă centrată pe imunitate, se reinterpretează multe dintre presupunerile tradiționale și se evidențiază ținte noi pentru intervenție. Cercetările continue asupra modului în care beta-amiloidul, microglia, mitocondriile, patogenii și metalele interacționează în creierul care îmbătrânește vor fi esențiale pentru prevenirea și tratarea acestei crize globale de sănătate publică. Progresul real va veni din integrarea datelor clinice, moleculare și imagistice, din abordări terapeutice țintite și din politici de sănătate care sprijină diagnosticarea timpurie și accesul la îngrijiri adaptate mecanismelor biologice identificate.
Sursa: sciencealert

Lasă un Comentariu