10 Minute
Noi cercetări sugerează că un subgrup de celule imune din creier poate trece într-o stare protectoare care încetinește principalele fenomene patologice ale bolii Alzheimer la șoareci. Înțelegerea acestui comutator molecular și funcțional ar putea indica strategii de imunoterapie care să stimuleze propriii apărători ai creierului să lupte împotriva bolii.
Când apărătorii devin protectori: rolul surprinzător al microgliilor
Microgliile sunt celulele imune rezidente ale sistemului nervos central: ele curăță resturile celulare, prunează sinapsele, supraveghează mediul neuronal și răspund la leziuni sau infecții. În boala Alzheimer activitatea lor a părea uneori ambivalentă — în anumite contexte microgliile contribuie la eliminarea proteinelor toxice, iar în altele pot amplifica inflamația nocivă care accelerează neurodegenerarea. Echipa multinațională condusă de neurocercetătoarea Pinar Ayata, de la Icahn School of Medicine, a cartografiat modul în care microgliile alternează între aceste moduri opuse în modele murine ale bolii Alzheimer, folosind abordări moleculare detaliate și imagistică avansată.
Prin profilări moleculare la nivel unic (single-cell RNA-seq), analiza epigenetică și imagistică de înaltă rezoluție, cercetătorii au identificat un subset de microglii care migrează spre depozitele de amiloid-beta — agregatele proteice caracteristice bolii Alzheimer — și care pot intra într-o stare neuroprotectoare distinctă. În acea configurație, celulele par să încetinească atât acumularea amiloidului, cât și agregarea proteinei tau, două procese proteice toxice corelate puternic cu declinul cognitiv. Această observație sugerează că microgliile nu sunt doar reacționare, ci pot adopta un program funcțional specific care limitează progresia patologiei.
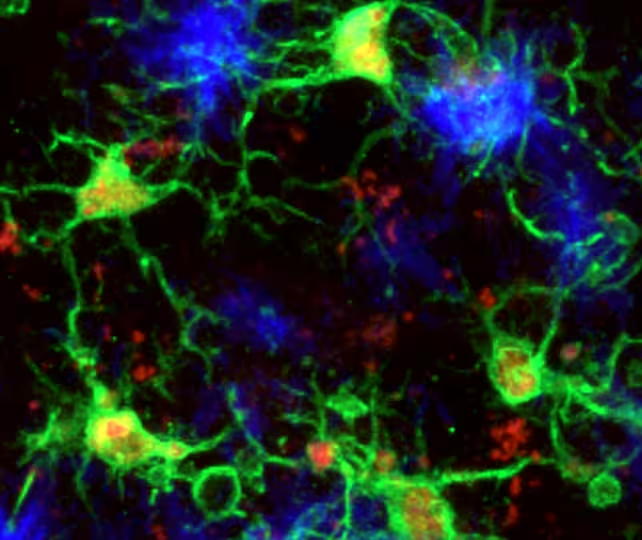
Microglii (verde) răspunzând la plăcile de amiloid‑beta (albastru) în creierul de șoarece.
PU.1 și CD28: o semnătură moleculară a protecției
Microgliile cu potențial protectiv împărtășesc două trăsături moleculare cheie: niveluri reduse ale factorului de transcriere PU.1 și expresie crescută a receptorului CD28, cunoscut în mod tradițional din contextul celulelor T periferice. PU.1 (un factor SPI1) joacă un rol crucial în diferențierea și identitatea celulelor mieloide, iar reglarea sa poate modifica profund funcția microglială. Pe de altă parte, CD28 este un receptor co‑stimulator asociat cu activarea și supraviețuirea celulelor T, iar descoperirea unei expresii mai mari a CD28 la un subset de microglii sugerează existența unui circuit de semnalizare comun între componente ale imunității periferice și cele ale creierului.
Când microgliile exprimă acest tandem molecular — PU.1 redus și CD28 ridicat — ele par mai bine echipate să limiteze extinderea plăcilor de amiloid-beta și să suprima transformarea tau într-o formă agregată patologică, în experimentele efectuate pe modele murine. Acest profil celular include modificări ale transcripției genelor implicate în fagocitoză, clarificare a proteinelor toxice, reglare a citokinelor anti‑inflamatorii și modificări epigenetice care pot stabiliza starea protectoare pe termen lung.
Pentru a testa relația de cauzalitate, echipa a blocat genetic producția de CD28 la șoareci. Rezultatul a fost un reviriment către un fenotip inflamator al microgliilor, o creștere a numărului de plăci amiloid și o pierdere clară a stării protectoare. Aceste manipulări experimentale întăresc ipoteza că nivelurile relative de CD28 și PU.1 sunt determinante pentru direcția funcțională pe care o adoptă microgliile — fie ca gardieni protectori, fie ca factori care favorizează inflamația și progresia bolii.
Date genetice umane vin să sprijine această biologie observată la animale: persoanele care poartă variante genetice naturale ce reduc expresia PU.1 în anumite tipuri de celule cerebrale prezintă, statistic, un debut al bolii Alzheimer la o vârstă mai înaintată comparativ cu media populației. Această corelație oferă un mecanism plauzibil care leagă variabilitatea genetică de momentul apariției bolii și sugerează că modificarea reglării PU.1 ar putea avea impact asupra vulnerabilității la Alzheimer.
Ce înseamnă aceasta pentru terapii și cercetări viitoare
Transformarea microgliilor în protecții durabile este o idee tentantă pentru dezvoltarea de noi tratamente împotriva Alzheimer, dar implică și numeroase precauții. Boala Alzheimer este o afecțiune multifactorială — o combinație complexă între predispoziție genetică, factori de mediu, sănătatea vasculară, comorbidități metabolice și procesul natural de îmbătrânire influențează riscul și severitatea. O terapie eficientă cel mai probabil va trebui să acționeze pe mai multe ținte sau căi biologice simultan: reducerea agregatelor proteice, limitarea inflamației cronice, protejarea sinapselor și îmbunătățirea homeostaziei metabolice a celulelor nervoase.
- Imunomodulare: Proiectarea de medicamente mici, biologice sau terapii genetice care cresc semnalizarea CD28 în microglii, sau care modulează expresia PU.1, ar putea împinge aceste celule spre starea protectoare identificată la șoareci. Aceste strategii includ proteine de fuziune, anticorpi bispecifici, terapii pe bază de ARNm sau editare epigenetică francă pentru a remodela transcriptomul microglial.
- Securitate și specificitate: O provocare majoră este evitarea activării imune generalizate: intensificarea răspunsului imunitar într-un mod nespecific poate agrava neuroinflamația și poate accelera pierderea neuronală. Astfel, strategiile terapeutice trebuie să fie foarte selective — fie prin livrare locală la creier (de exemplu, vectori virali cu tropism pentru microglii), fie prin țintirea unor semnale intracelulare specifice fenotipului protectiv.
- Translație: Microgliile din creierul uman împărtășesc caracteristici cu cele murine, dar nu sunt identice. Confirmarea existenței aceluiași program protector la oameni, identificarea biomarkerilor serologici sau imagistici care reflectă starea microglială și testarea în modele umane (organoide cerebrale, culturi derivate din celule stem umane) sunt pași critici înainte de orice încercare clinică.
Experții citați în studiu subliniază atât promisiunea, cât și prudența. Anne Schaefer de la Icahn School of Medicine remarcă faptul că microgliile „nu sunt doar respondente distructive în boala Alzheimer — ele se pot transforma în protectoare ale creierului”, pe când geneticiana Alison Goate afirmă că aceste rezultate ajută la explicarea asocierii între niveluri mai scăzute ale PU.1 și riscul redus de Alzheimer. Epigeneticianul Alexander Tarakhovsky, de la Rockefeller University, leagă această descoperire de un cadru mai larg de reglare imună, sugerând că microgliile protectoare din creier ar putea reflecta roluri similare cu cele ale celulelor T reglatoare (Treg) din periferie, care mențin homeostazia și limitează răspunsurile imune dăunătoare.
Expert Insight
„Acest studiu adaugă o piesă importantă la puzzle‑ul Alzheimer prin arătarea că identitatea imună în creier poate fi benefică, nu doar dăunătoare”, spune Dr. Maya Elfenbein, neuroimunolog și comunicatoare științifică. „Provocarea de acum este dublă: demonstrarea faptului că același mecanism funcționează la oameni și apoi dezvoltarea unor mijloace precise de a transforma microgliile în acea stare protectoare, fără a declanșa inflamație nocivă.”
Privind înainte, această linie de cercetare deschide un drum către strategii imunoterapeutice care tratează Alzheimer nu doar prin îndepărtarea proteinelor anormale, ci prin reprogramarea propriei apăraresă imune a creierului. Această abordare complementară ar putea lucra în sinergie cu terapii bazate pe anticorpi monoclonali anti‑amiloid, mici molecule care vizează tau, terapii antiinflamatorii direcționate și intervenții asupra factorilor de risc prin stil de viață care reduc impactul vascular și metabolic.
Totuși, autorii subliniază că această apărare microglială, deși promițătoare, nu pare suficientă pentru a opri singură progresia bolii în modelele actuale. În practică, conversia microgliilor în protecții — dacă va fi realizabilă la oameni — ar constitui un instrument nou și puternic în trusa terapeutică pentru Alzheimer, dar probabil va fi aplicată în combinație cu alte intervenții pentru a obține efecte clinice semnificative.
Pe lângă implicațiile terapeutice, constatările ridică întrebări fundamentale despre dinamica imunității în creier: cât de stabilă este starea protectoare a microgliilor în timp? Ce semnale locale (de exemplu oligodendrocite, astrocite, semnale neuronale) sau sistemice (citokine, metaboliți) mențin sau inversează această stare? Cum interacționează epigenetica cu semnalizarea receptorilor precum CD28 pentru a crea un efect de memorie celulară? Răspunsurile la aceste întrebări vor defini, probabil, strategiile viitoare pentru monitorizarea și manipularea microgliilor în boala Alzheimer.
Un alt aspect critic este dezvoltarea biomarkerilor de stare microglială, necesari pentru a urmări efectul terapeutic în studiile clinice. Tehnici imagistice precum PET cu trasori specifici pentru activarea microglială, analize de proteine și microARN în lichidul cefalorahidian sau sânge, și profilări moleculare din probe periferice ar putea furniza semnale surrogat pentru prezența și durabilitatea fenotipului protectiv. Aceste instrumente sunt esențiale pentru a determina dacă o intervenție farmacologică reușește cu adevărat să „aprindă” programul protectiv al microgliilor la pacienții umani.
În final, integrarea datelor genetice umane cu rezultatele preclinice oferă o bază solidă pentru prioritizarea țintelor terapeutice. Identificarea variantelor genetice care influențează expresia PU.1 sau modularea căii CD28 pot ghida atât selecția subgrupurilor de pacienți care ar beneficia mai mult de anumite terapii, cât și dezvoltarea unor abordări personalizate. Această convergență între genetică, biologie moleculară și imunoterapie reprezintă o direcție pragmatică și stimulativă pentru viitoarele eforturi clinice în Alzheimer.
Pe termen lung, o strategie eficientă ar putea combina: (1) reduceri precise ale sarcinii proteice prin anticorpi sau imunoterapii active, (2) reprogramare imună locală pentru a favoriza fenotipuri microgliale protective, (3) intervenții asupra sănătății vasculare și metabolice și (4) programe de prevenție și diagnostic precoce bazate pe biomarkeri. Această combinație ar putea, în final, să modifice cursul bolii, nu doar să amelioreze simptomele.
În concluzie, descoperirea unui program microglial protectiv, corelat cu niveluri reduse de PU.1 și expresie crescută a CD28, extinde orizontul terapeutic pentru boala Alzheimer. Rămâne esențială validarea acestor rezultate la oameni, dezvoltarea de terapii specifice și sigure și crearea unor biomarkeri care să permită monitorizarea efectului. Dacă aceste condiții se vor îndeplini, reprogramarea microgliilor ar putea deveni o piesă centrală a strategiilor viitoare de prevenție și tratament pentru demență și neurodegenerare.
Sursa: sciencealert

Lasă un Comentariu