10 Minute
Oechipe de oameni de știință au folosit un tratament nou bazat pe nanoparticule pentru a restabili o cale critică de transport la bariera hemato-encefalică (BHE) la șoareci, permițând eliminarea în câteva ore a depozitelor toxice de amyloid-beta asociate bolii Alzheimer. După trei injecții, animalele care anterior prezentaseră declin cognitiv au performat similar controalelor sănătoase, iar beneficiile au persistat luni de zile. Acest rezultat sugerează că intervenția asupra funcției vasculare la nivelul BHE poate restabili procese de curățare endogene esențiale pentru homeostazia cerebrală.
Fixarea porții în loc de ocolirea ei
De decenii, cercetătorii au tratat bariera hemato-encefalică ca pe o problemă de ocolit — un zid celular foarte strâns care împiedică medicamentele să ajungă în creier. Numeroase grupuri au încercat să camufleze medicamente în nanoparticule sau să deschidă temporar bariera cu ultrasunete pentru a permite trecerea tratamentelor. Totuși, o colaborare internațională condusă de Institutul pentru Bioinginerie din Catalonia (IBEC) și West China Hospital, Sichuan University (WCHSU) reformulează această abordare: BHE însăși ar putea fi disfuncțională în Alzheimer, iar repararea mecanismelor sale de transport ar putea permite creierului să elimine din nou deșeurile toxice.
Schimbarea perspectivei de la "a forța" trecerea medicamentelor către creier la "a repara" mecanismele de export ale creierului reprezintă o transformare conceptuală importantă. În loc să vedem BHE doar ca pe o barieră fizică, această abordare o consideră un element dinamic al fiziologiei cerebrale, ale cărui disfuncții pot contribui activ la acumularea de proteine patologice și la progresia neurodegenerativă. Accentul pus pe sănătatea vasculară și pe transportul molecular deschide noi direcții pentru terapii complementare, inclusiv pentru strategiile bazate pe imunoterapie, medicamente cu molecule mici și intervenții de tip stil de viață.
Cum a funcționat experimentul
Cercetătorii au dezvoltat nanoparticule concepute nu doar pentru a transporta medicamente, ci pentru a modifica activ comportamentul celular la nivelul BHE. Ținta moleculară a fost receptorul LRP1 endotelial, exprimat pe partea expusă sângelui a vasculaturii cerebrale și implicat în transportul amyloid-beta din creier către circulația sanguină. În modele murine modificate genetic pentru a reproduce aspecte ale bolii Alzheimer, trei injecții cu aceste nanoparticule au declanșat o cascadă de evenimente moleculare care a restaurat această cale de clarificare (clearance).
Nanoparticulele acționează aici ca agenți activi la nivel molecular: ele nu sunt doar vehicule pasive, ci conțin liganzi și componente care interacționează cu LRP1 și semnalizarea celulară asociată, reactivând transportul transendotelial al amyloid-beta. Prin modularea expresiei și funcționalității receptorilor, precum și prin influențarea căilor de semnalizare intracelulară implicate în endocitoză și transcitoză, aceste nanoparticule facilitează transferul moleculelor toxice din parenchimul cerebral în circulație, de unde ele pot fi eliminate sistemic.
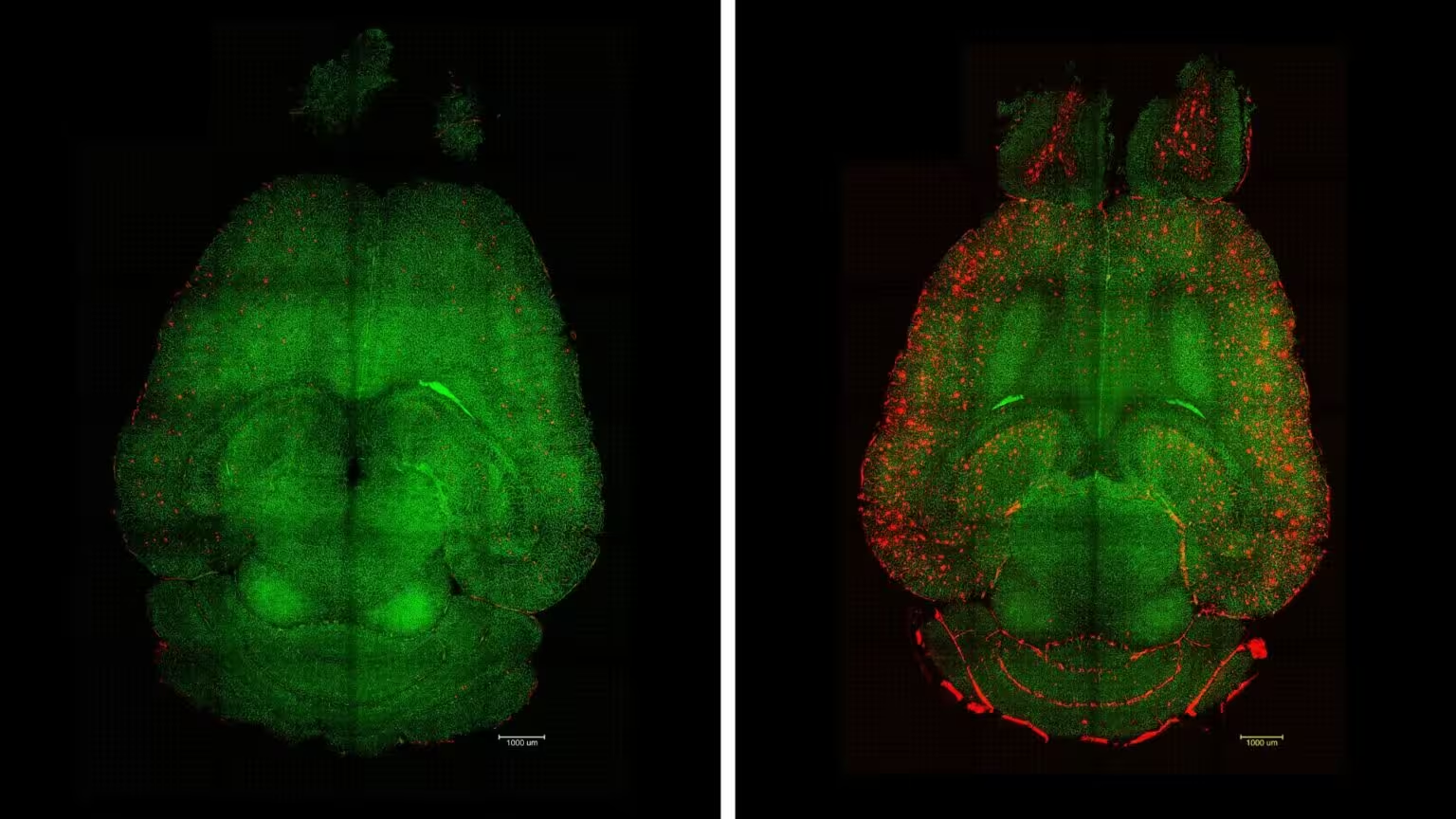
Plăcile de amyloid-beta (roșu) au fost eliminate din creierele șoarecilor tratați (stânga), dar nu și din controalele netratate (dreapta). Vasele barierei hemato-encefalice sunt prezentate în verde. (IBEC)
La câteva ore de la prima administrare s-a înregistrat o reducere a încărcăturii de plăci amyloid-beta de aproape 45%. După seria completă de injecții, animalele tratate și-au recăpătat capacitățile de învățare spațială și memorie, comparabile cu cele ale colegilor sănătoși. Un aspect crucial este durabilitatea efectului: îmbunătățirile cognitive au persistat cel puțin șase luni, ceea ce indică o resetare relativ stabilă a funcției de clarificare, nu doar o ameliorare tranzitorie a simptomelor.
De ce contează: mutarea accentului către reparația vasculară
Majoritatea medicamentelor actuale pentru Alzheimer vizează îndepărtarea sau neutralizarea plăcilor și încurcăturilor (tau) din interiorul creierului. Medicamente precum lecanemab și donanemab au demonstrat încetinirea progresiei simptomelor în anumite studii clinice, dar nu revin la starea inițială de sănătate neuronală. Echipa IBEC–WCHSU susține că concentrarea exclusivă pe agregatele intraneuronale omite granițele creierului — locul unde transportul afectat și disfuncția vasculară pot iniția sau accelera neurodegenerarea.
Restabilirea traficului prin BHE ar putea permite creierului să reia eliminarea nu doar a amyloid-beta, ci și a unui spectru mai larg de molecule toxice, incluind metaboliți proinflamatori, proteine malpliate și fragmente celulare. Această abordare are implicații terapeutice profunde: în loc să ne bazăm exclusiv pe tratamente exogene care încearcă să neutralizeze sau să degradeze acumulările patologice, am putea reactiva mecanismele native de „curățare” ale creierului, facilitând homeostazia și reducând încărcătura toxică globală.
Giuseppe Battaglia, bioinginer la IBEC, explică: „Credem că funcționează ca o cascadă: când specii toxice precum amyloid-beta se acumulează, boala progresează. Dar odată ce vasculatura își recâștigă funcționalitatea, începe să elimine amyloid-beta și alte molecule dăunătoare, permițând întregului sistem să-și refacă echilibrul.” Această metaforă a cascadei evidențiază rolul central al integrității vasculare și al traiectelor de transport (LRP1, transcitoză endotelială, drenaj perivascular) în menținerea sănătății neuronale.
Detalii experimentale și limite
Efectele raportate provin din studii preclinice pe șoareci care vizează un genotip specific asociat demenței. În această abordare, nanoparticulele acționează ca agenți activi sau „microingineri” la nivel molecular, modulând activitatea receptorilor și semnalizarea celulară pentru a reabilita eliminarea amyloidului peste BHE. Cercetătorii au folosit tehnici histologice detaliate, imunofluorescență, imagistică de înaltă rezoluție și teste comportamentale standardizate (de exemplu, teste de labirint și probe de memorie spațială) pentru a cuantifica reducerea plăcilor și restabilirea funcției cognitive.
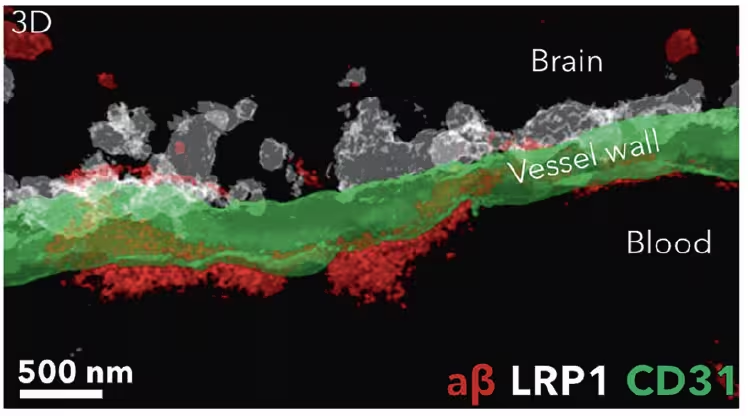
După tratamentul cu nanoparticule (alb), depozitele de amyloid-beta (roșu) au fost eliminate de pe partea cerebrală a barierei hemato-encefalice (verde) și preluate în fluxul sanguin. (Chen et al., STTT, 2025)
Cu toate acestea, sunt necesare prudență și diligență științifică. Modelele murine și cele umane diferă în arhitectura vasculară cerebrală, compoziția imunitară și dinamica proteinei amyloid. Experții independenți subliniază că succesul la rozătoare este un pas încurajator, dar nu garantează eficacitatea clinică la oameni. Studiul a examinat un număr limitat de animale și un subtip restrâns de boală; teste extinse vor fi necesare pentru a evalua siguranța pe termen lung, ferestrele de dozare, potențialele reacții imune sau inflamații și dacă căile similare pot fi restabilite în creierele îmbătrânite ale pacienților umani.
Aspecte tehnice critice pentru translare includ: compoziția nanoparticulelor (materialele de bază, biodegradabilitatea, stabilitatea), specificitatea țintirii către celulele endoteliale cerebrale, capacitatea de a evita reacțiile adverse sistemice, și metodologii robuste de fabricație în conformitate cu bunele practici de fabricație (GMP). De asemenea, va fi esențială monitorizarea potențialelor efecte secundare, precum alterarea permeabilității BHE, edemul cerebral sau activarea microglială excesivă, care ar putea contrabalansa beneficiile de clarificare.
Efecte potențiale în lanț asupra terapiilor pentru Alzheimer
Repararea transportului prin BHE ar putea completa terapiile existente, nu neapărat să le înlocuiască. Dacă funcția vasculară este restabilită, alte tratamente — anticorpi monoclonali, molecule mici, sau intervenții privind stilul de viață (exercițiu, dietă, controlul factorilor cardiovasculari) — ar putea deveni mai eficiente pentru că creierul ar putea elimina mai eficient produșii patologici și reziduurile metabolice.
Conceptul lărgește, de asemenea, spațiul de țintire pentru dezvoltatorii de medicamente: în loc să proiecteze exclusiv molecule capabile să traverseze BHE, ar fi posibil să se creeze agenți care reactivează sistemele endogene de clarificare ale creierului, precum LRP1-dependent transport, drenaj perivascular și fluxul glinfatic (glymphatic), optimizând astfel homeostazia proteică și reducând stresul proteostatic neuronal.
În practică, o strategie combinată ar putea include o terapie de "resetare vasculară" folosind nanoparticule orientate către LRP1, urmată de administrarea unor anticorpi anti-amyloid sau terapii care vizează tau, pentru a elimina fracțiunile rămase de proteine patologice. Această abordare multinivel ar putea reduce dozele necesare de anticorpi, minimizând riscul de efecte adverse asociate cu imunoterapiile, cum ar fi ARIA (edem sau hemoragii asociate anticorpilor anti-amyloid).
Perspective ale experților
Dr. Laura Mendes, neurocercetătoare specializată în biologie neurovasculară la Global Brain Institute, comentează: „Această lucrare reformulează problema. În loc să forțăm medicamentele printr-o poartă defectă, propune reparația instalației — refacerea mecanismelor care în mod normal mențin creierul curat. Traducerea acestui concept la om va fi provocatoare, dar ideea de a restaura căi endogene de clarificare este promițătoare și se aliniază cu dovezile tot mai multe că sănătatea vasculară este centrală pentru riscul de demență.”
Julia Dudley de la Alzheimer’s Research UK, care nu a participat la studiu, a exprimat optimism prudent: rezultatele „se adaugă la dovezile în creștere că repararea barierei hemato-encefalice ar putea oferi o nouă abordare terapeutică pentru Alzheimer”, subliniind în același timp diferențele dintre modelele animale și boala umană.
Ce urmează?
Echipa plănuiește lucrări preclinice suplimentare pentru a evalua siguranța pe termen lung, intervalele de dozare și eficacitatea în diverse modele experimentale. Cercetări paralele vor fi necesare pentru a determina dacă căile centrate pe LRP1 pot fi modulate în siguranță la oameni și dacă platformele de nanoparticule pot fi scalate și produse conform standardelor clinice. Evaluările vor include studii pe modele animale mai mari, teste toxice detaliate, și dezvoltarea strategiilor de livrare și monitorizare imagistică pentru a cuantifica efectele la nivelul BHE în timp real.
Dacă aceste rezultate vor fi replicate și extinse, strategia de reparație vasculară ar putea deschide o nouă linie de atac împotriva bolii Alzheimer: una care valorifică sistemele proprii de curățare ale creierului în loc să se bazeze exclusiv pe agenți exogeni pentru a realiza întreaga muncă. În plus, punerea în context a sănătății vasculare — controlul tensiunii arteriale, managementul hipercolesterolemiei, abstinența de la fumat și activitatea fizică regulată — rămâne un element complementat de aceste inovații terapeutice, deoarece optimizarea factorilor cardiovasculare poate susține capacitatea naturală de curățare a creierului.
Pe termen lung, colaborarea între bioingineri, neurologi, imunologi și companii farmaceutice va fi esențială pentru a transforma aceste descoperiri preclinice într-o terapie sigură și eficientă pentru pacienți. Monitorizarea biomarkerilor (ex. niveluri de amyloid-beta în lichidul cefalorahidian și sânge, imagistică PET pentru amyloid), combinată cu evaluări neuropsihologice și măsuri de siguranță, va ghida dezvoltarea clinică, care trebuie să clarifice criteriile de selecție a pacienților, ferestrele terapeutice și potențialele combinații terapeutice optime.
Sursa: sciencealert

Lasă un Comentariu