10 Minute
Cancerul pancreatic nu așteaptă. El își caută aliați în țesut cu mult înainte ca un tumoare detectabilă să apară, iar unul dintre primii recruți este surprinzător: sistemul nervos. Cercetători de la Cold Spring Harbor Laboratory raportează că fibrele nervoase și fibroblastele specializate formează o rețea cooperantă care ajută leziunile precanceroase să evolueze către boală malignă.
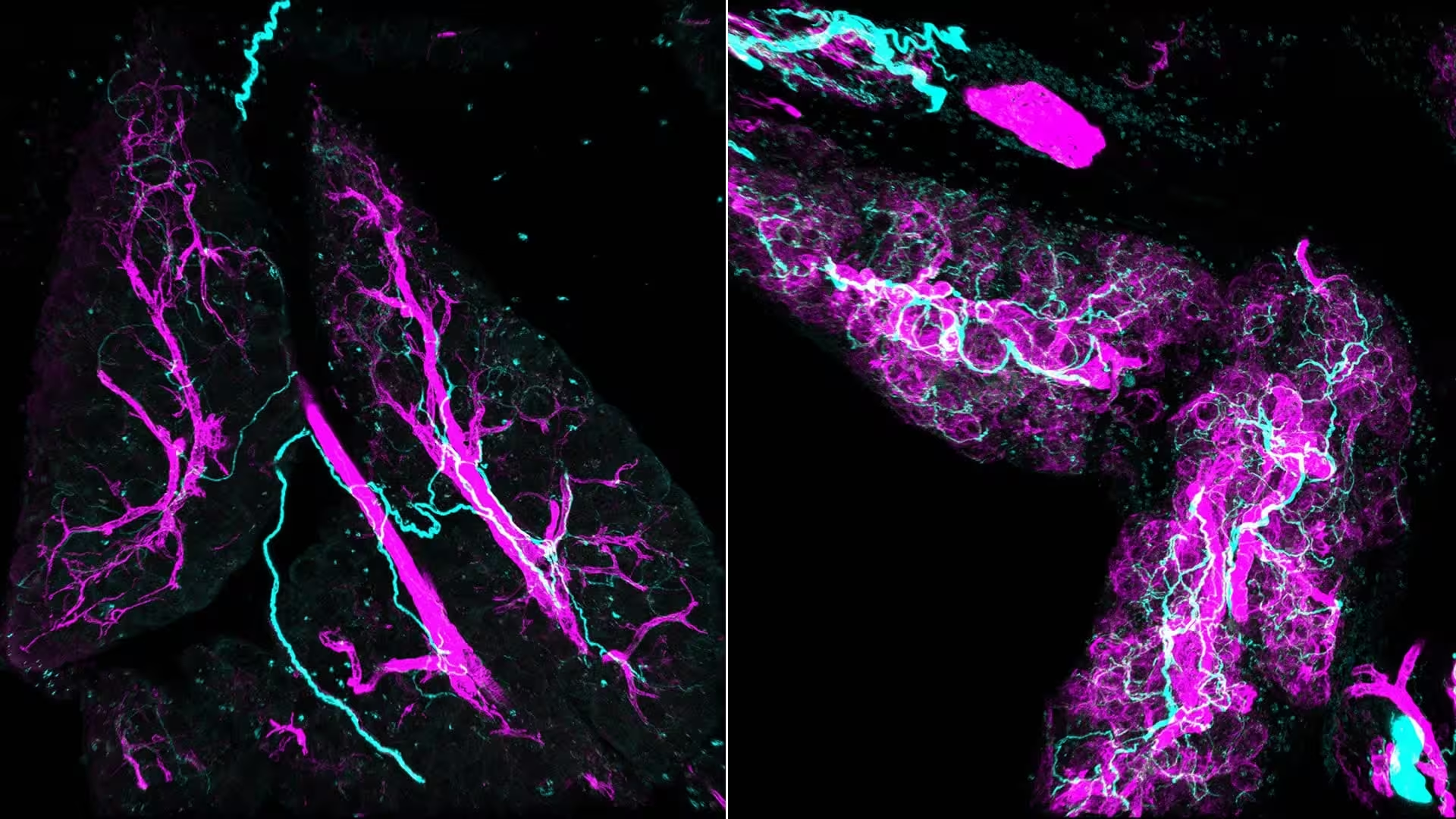
Semnalele de stres redesenează țesuturile în timpul inflamației și al cancerului. Stânga: întreținerea normală a țesutului. Dreapta: semnalele de stres "activează" fibroblastele, transformându-le în myCAFs (mov) care atrag activ nervii (cyan) în pancreas.
Gândiți-vă la pancreas ca la un cartier liniștit. Apoi câteva case se schimbă—celulele încep să se comporte anormal. În loc de o invazie imediată, cartierul își remodelază structura: celule de susținere numite fibroblaste trec într-o stare activată, semnalizarea imunitară se modifică, iar fibre nervoase se extind în zonă. Rezultatul este un microambient remodelat care favorizează transformarea malignă. Nu este vorba doar de celulele canceroase care preiau controlul; este o colaborare secretă între componente diferite ale țesutului.
Descoperirile pun în discuție conceptele clasice despre tumoră: nu mai este doar un conglomerat de celule cu mutații genetice, ci un ecosistem dinamic care include fibroblaste asociate cancerului, celule imune și componente ale sistemului nervos. În acest articol traducem și extindem principalele idei ale studiului, explicând metoda științifică, mecanismele moleculare și implicațiile clinice pentru diagnostic și tratament.
Vizualizarea invizibilului prin imagistică 3D
Microscopia tradițională tinde să aplatizeze țesuturile complexe în secțiuni subțiri, transformând tracturile nervoase lungi în puncte răzlețe pe microscop. Echipa a folosit imunofluorescența pe probe întregi (whole-mount immunofluorescence) și tehnici de clarificare a țesutului pentru a cartografia leziunile în trei dimensiuni, iar imaginea a fost revelatoare: pachete dense, împletite, de nervi care se strecoară printre și în jurul fibroblastelor activate—myofibroblastic cancer-associated fibroblasts, sau myCAFs.
Reconstrucțiile 3D nu sunt doar spectaculoase din punct de vedere vizual; ele schimbă povestea biologică. Nervii nu sunt doar „caburi pasive” pe care cancerul le exploatează mai târziu. Ei sunt participanți timpurii, atrași de semnale chimice emise de myCAFs și, la rândul lor, furnizând semnale care activează suplimentar aceleași fibroblaste. Acest dialog bidirecțional stabilește un circuit auto-reinforțator care promovează comportamente celulare asociate cu creșterea tumorală și rezistența la stres.
Tehnici și instrumente folosite
Pe lângă imunofluorescența pe sondă întreagă, cercetătorii au integrat tehnici de clarificare optică (tissue clearing) și microscopie cu foiță luminoasă (light-sheet microscopy) pentru a păstra integritatea tridimensională a țesutului. Apoi, reconstrucția digitală și analiza algoritmică au permis cuantificarea densității nervoase, a apropierei spațiale între fibre și myCAFs și a modificărilor morfologice ale microambientului. Analizele statistice comparative între probe normale, leziuni precanceroase și tumori invazive au confirmat o creștere progresivă a interacțiunilor nerve–fibroblast pe măsură ce boala avansa.
Aceste abordări multidisciplinare—combinând biologie moleculară, imagistică avansată și modelare computațională—ajută la detectarea unor structuri care au fost anterior invizibile. Acest lucru este crucial pentru înțelegerea timpurie a proceselor care pregătesc terenul pentru cancerul pancreatic și pentru identificarea unor posibile puncte de intervenție.
Mecanismul molecular: norepinefrină, calciu și un ciclu autoîntreținut
Un element-cheie al buclei de semnalizare este norepinefrina, un neurotransmițător eliberat de fibrele nervoase simpatice. Când norepinefrina ajunge la fibroblaste, ea activează receptori adrenegici care declanșează semnalizare bazată pe calciu intracelular—o modificare biochimică rapidă care amplifică funcțiile pro-tumorale ale fibroblastelor și încurajează creșterea suplimentară a nervilor în acea zonă.
Răspunsul fibroblastelor include secreția de factori chemoattractanți (molecule care atrag axoni), eliberarea de componente ale matricei extracelulare remodeling (MMP-uri, colagen modificat) și producerea de citokine care modulează răspunsul imunitar local. În combinație, aceste schimbări creează un microambient favorabil pentru proliferarea și supraviețuirea celulelor transformate.
Modelele experimentale sugerează o ordine logică: myCAFs emit semnale atractante; nervii simpatici se extind în leziune răspunzând acestor semnale; nervii eliberează norepinefrină care, la rândul său, activează fibroblastele; fibroblastele devin mai agresive și sprijină progresia leziunii. Oricare dintre legături, dacă este perturbată, slăbește lanțul evenimentelor și poate încetini evoluția spre malignitate.
Validarea în modele experimentale
Analizele au folosit atât modele murine genetically engineered cât și culturi de celule umane pentru a reproduce secvența semnalelor. Manipularea genetică a unor markeri specifici myCAFs, blocarea farmacologică a semnalizării adrenergice sau ablația fibrelor nervoase în modele preclinice au arătat că interferența cu activitatea simpatică reduce activarea fibroblastelor și încetinește creșterea tumorii. Un raport menționat de autori a observat o reducere apropiată de 50% a dimensiunii tumorale în modelele afectate după intervenții care perturbau semnalizarea adrenergică.
Implicații terapeutice și oportunități de repurposing
Această descoperire deschide uși practice pentru tratament. Medicamente deja aprobate pentru afecțiuni cardiovasculare sau urologice, cum ar fi blocanții adrenergici (de exemplu doxazosin) sau beta-blocanți nonselectivi (propranolol), ar putea fi repurpose-ate pentru a perturba remodelarea microambientului indusă de nervi. În combinație cu chimioterapia sau terapiile imune, astfel de agenți pot reduce progresia în fereastra clinică când boala este încă localizată și mai vulnerabilă la intervenție.
Strategiile terapeutice posibile includ:
- Blocarea receptorilor adrenegici pe fibroblaste, pentru a opri efectele norepinefrinei;
- Utilizarea de toxine neuronale sau proceduri denervative locale în modele selectate, pentru a limita influența nervilor simpatici;
- Combinații cu chimioterapie sau inhibitori imuni, folosite pentru a profita de o microambient mai puțin protector pentru celulele tumorale;
- Dezvoltarea de inhibitori specifici ai factorilor secretați de myCAFs care atrag axonii (de exemplu inhibitori ai NGF/GDNF sau a unor chemoatractanți specifici).
Trebuie subliniat că traducerea clinică va cere studii riguroase. Blocarea semnalizării adrenergice sistemice poate avea efecte adverse semnificative—hipotensiune, tulburări cardiovasculare sau efecte neurologice. Prin urmare, va fi esențial să se evalueze dozele, țintirea locală și combinațiile terapeutice pentru a maximiza beneficiul și a minimiza riscul.
Diagnosticul: nervii ca biomarkeri timpurii
Dincolo de opțiunile terapeutice, studiul sugerează o implicație diagnostică importantă: remodelarea nervoasă ar putea servi drept biomarker timpuriu. Dacă clinicienii pot detecta sau imagistica infiltrația neurală în mod fiabil, ar putea identifica țesuturile la risc mai devreme și interveni înainte ca tumorile să se consolideze.
Instrumente potențiale pentru aceasta includ:
- Imagini avansate PET cu trasori specifici pentru receptorii adrenegici sau pentru markeri de innervație;
- RMN neurografic sau tehnici de difuzie pentru a evalua integritatea tracturilor nervoase în vecinătatea leziunilor pancreatice;
- Biomarkeri serici sau tisulari ai activării myCAFs (profiluri de citokine, proteaze matriceale, markeri de remodelare a colagenului).
Dezvoltarea unor algoritmi AI care combină imagistica 3D cu date moleculare ar putea crește precizia în identificarea leziunilor precursoare care vor evolua spre cancer invaziv.
Perspective ale experților
„Credeam că nervii contează în principal pentru durere sau pentru invazie în stadii târzii,” spune un cercetător senior implicat în studiu. „Acest studiu inversează acea perspectivă: nervii sunt arhitecți activi ai microambientului tumoral încă de la început. Blocarea semnalelor lor ar putea fi o strategie preventivă, nu doar paliativă.”
Comentariul subliniază o schimbare conceptuală: în loc să tratăm doar componenta celulară a tumorii, ar putea fi mai eficient să atacăm întregul ecosistem care permite stabilirea și avansarea cancerului. Această abordare multifactorială are potențialul de a îmbunătăți supraviețuirea și răspunsul la terapie pentru o tumoră care, în prezent, este asociată cu detectare târzie și rezultate slabe.
Un efort concentrat va fi necesar pentru a traduce aceste descoperiri în studii clinice umane. Cercetătorii trebuie să definească care molecule semnal sunt cele mai critice, dacă blocarea activității simpatice afectează funcția normală a țesutului pancreatic sau a altor organe și cum este mai bine să se combine medicamentele țintite pe nervi cu terapiile existente. Finanțatori și grupuri de advocacy pentru pacienți și-au exprimat deja interesul, recunoscând că unghiuri noi pot fi esențiale pentru a îmbunătăți rezultatele într-un cancer notoriu pentru detectarea ulterioară și rata scăzută de succes terapeutic.
Consecințe conceptuale și direcții viitoare
Rămâne un înțeles mai larg: tumorile sunt ecosisteme. Ele recrutează, conving și cooptă celulele și sistemele învecinate—inclusiv sistemul nervos. Detectarea acestui recrutământ în faze cât mai timpurii poate întrerupe „conversația” dintre componentele microambientului și astfel poate opri progresia bolii într-un stadiu în care intervenția este mai eficientă.
Direcții viitoare de cercetare recomandate includ:
- Cartografiere sistematică a tipurilor de fibroblaste asociate cancerului (myCAFs versus alte subtipuri) și a receptorilor adrenegici prezenți pe acestea;
- Identificarea factorilor chemoattractanți esențiali care trimit semnale axonale și dezvoltarea de inhibitori specifici;
- Studii preclinice care evaluează combinații de blocanți adrenergici cu imunoterapii și chimioterapii convenționale;
- Dezvoltarea de metode imagistice clinice pentru detectarea innervației pancreatice crescute și validarea acestor semne ca biomarkeri predicativi;
- Evaluări de siguranță privind blocarea sistemului nervos simpatic la pacienți cu comorbidități cardiovasculare.
Pe lângă aceste direcții, colaborarea între biologi, clinicieni, ingineri în imagistică și companii farmaceutice va fi crucială pentru a transforma observațiile de laborator în strategii terapeutice și diagnostice viabile.
În concluzie, studiul relievează o dimensiune neglijată a cancerului pancreatic: cooperarea între nervi și fibroblaste creează un microambient care sprijină transformarea malignă. Intervenția timpurie asupra acestei cooperări—prin blocarea semnalizării adrenergice, modificarea comportamentului myCAFs sau imagistică pentru detectare timpurie—oferă o abordare complementară promițătoare la strategiile tradiționale care vizează exclusiv celulele tumorale. Abordând ecosistemul tumoral, nu doar cancerul, am putea obține un impact clinic semnificativ în lupta împotriva unei boli devastatoare.
Sursa: scitechdaily

Lasă un Comentariu