9 Minute
Un studiu promițător de laborator arată că un candidat‑medicament numit P7C3-A20 poate inversa declinul cognitiv la modele murine cu patologie avansată asemănătoare bolii Alzheimer. Prin restabilirea chimiei energetice celulare și reducerea inflamației, cercetătorii susțin că creierul deteriorat poate recupera funcții importante chiar și fără eliminarea agregatelor proteice caracteristice bolii.
Cum un singur compus vizează energia cerebrală
Cercetătorii de la Case Western Reserve University și colaboratorii au testat P7C3-A20, un compus neuroprotector care contribuie la restabilirea echilibrului nicotinamide adenine dinucleotide (NAD+). NAD+ este o moleculă metabolică centrală: celulele o folosesc pentru a converti nutrienții în energie utilizabilă și pentru a susține repararea ADN-ului, homeostazia proteinelor și procesele mitocondriale. Nivelurile scăzute de NAD+ sunt corelate cu îmbătrânirea biologică și cu o serie de afecțiuni neurodegenerative, inclusiv boala Alzheimer.
În studiu, șoareci cu simptome avansate asemănătoare Alzheimer au primit injecții zilnice cu P7C3-A20 timp de șase luni. Tratamentul a readus nivelele de NAD+ aproape de valorile normale, a redus markeri ai inflamației și ale deteriorării ADN-ului și — esențial — a oprit deteriorarea neuronală. Această recuperare biochimică s‑a tradus în îmbunătățiri măsurabile ale învățării și memoriei la ambele linii de șoareci testate, în teste comportamentale standardizate.
Din punct de vedere mecanic, restabilirea NAD+ susține capacitatea celulelor neuronale de a menține funcții energetice, de a repara leziuni moleculare și de a regla procesele de autofagie și proteostază. P7C3-A20 acționează ca un agent neuroprotector cu efect asupra metabolismului celular, ceea ce îl diferențiază de terapiile care vizează exclusiv reducerea agregatelor proteice (anti-amyloid sau anti-tau). Prin protejarea și „re-energizarea” neuronilor, compusul pare să îmbunătățească reziliența neuronală, reducând pe termen scurt și mediu declinul cognitiv legat de boala neurodegenerativă.
Două modele diferite de Alzheimer, un rezultat comun
Echipa a folosit deliberat două modele genetice distincte de șoareci, fiecare reprezentând una dintre cele două patologii emblematice ale Alzheimer: plăcile de amyloid‑beta și încurcăturile de proteine tau. Aceste proteine agregate sunt frecvent observate în creierele pacienților cu Alzheimer, dar rolul lor exact în producerea declinului cognitiv rămâne complex și discutabil. Modelele preclinice reproduc diferite aspecte moleculare și comportamentale ale bolii, oferind un cadru comparativ pentru evaluarea terapiilor potențiale.
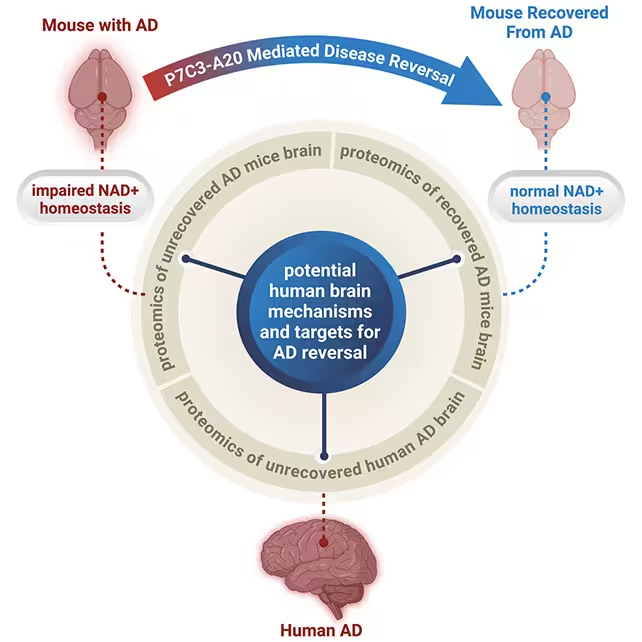
Remarcabil, P7C3-A20 a îmbunătățit comportamentul și markeri neuropatologici în ambele modele fără a elimina plăcile sau încurcăturile proteice. „Restabilirea echilibrului energetic al creierului a realizat o recuperare patologică și funcțională în ambele linii de șoareci cu Alzheimer avansat,” afirmă neurocercetătorul și psihiatrul Andrew Pieper. Rezultatul sugerează că, dacă neuroni‑i recâștigă suficientă reziliență metabolică, ei pot tolera — sau compensa parțial — prezența agregatelor proteice. Aceasta este o schimbare conceptuală importantă: în loc să urmărim exclusiv dizolvarea plăcilor și a încurcăturilor, putem încerca să consolidăm rezistența celulară și mecanismele de reparare.
Ce înseamnă aceste rezultate pentru cercetarea Alzheimer
Restaurarea NAD+ pare mecanismul critic din spatele recuperării observate. Studii anterioare pe animale au arătat că amplificatorii de NAD+ (de ex. precursorii NAD cum sunt nicotinamid mononucleotid — NMN — sau nicotinamid ribozid — NR) pot îmbunătăți rezultatele după traumatisme cerebrale sau ischemie; această lucrare extinde observațiile spre o formă cronică de neurodegenerare. Lucrarea publicată în Cell Reports Medicine (2025) raportează că markerii de inflamație și de deteriorare a ADN‑ului au scăzut la animalele tratate, indicând că celulele au recăpătat capacitatea de a menține funcții normale și de a rezista stresului oxidativ și inflamator cronic.
Pe plan molecular, niveluri adecvate de NAD+ susțin activitatea enzimelor NAD‑dependente, precum sirtuinele (SIRT), care reglează repararea ADN‑ului, metabolismul energetic și răspunsul la stres, precum și polimerazele PARP implicate în răspunsul la daunele ADN. Prin modularea acestor căi, P7C3-A20 ar putea reduce activarea cronică a microgliei și producția de citokine proinflamatorii, contribuind astfel la un mediu cerebral mai puțin dăunător pentru sinapse și circuitele cognitive.
Cercetătorii subliniază, însă, prudența: trecerea de la rezultate în modele animale la terapii eficiente și sigure pentru oameni este complexă și plină de provocări. Parametrii clinici esențiali — doze adecvate, momentul administrării în cursul bolii, efectele secundare acute și cronice, precum și siguranța pe termen lung — trebuie stabiliți în studii clinice bine controlate. De exemplu, o activare excesivă a căilor legate de NAD+ poate, în anumite contexte experimentale, să favorizeze procese proliferative; astfel, riscul teoretic de predispoziție la anumite tipuri de cancer impune monitorizare atentă și calibrare precisă a terapiei umane potențiale.
De ce aceasta nu înseamnă un leac instant
Boala Alzheimer este multifactorială: implică predispoziții genetice, agregare proteică, inflamație cronică, sănătate vasculară deficitară, disfuncție mitocondrială și factori de mediu. Efectul P7C3-A20 nu elimină plăcile sau încurcăturile tau, dar pare să permită neuronilor să funcționeze în prezența acestor patologii — o schimbare conceptuală relevantă pentru strategia terapeutică. „Observarea acestui efect în două modele animal diferite, fiecare cu cauze genetice distincte, întărește ideea că recuperarea din boală avansată ar putea fi posibilă la oameni cu AD atunci când echilibrul NAD+ al creierului este restabilit,” spune Pieper.
Practic, intervențiile care sporesc reziliența metabolică ar putea oferi o fereastră de oportunitate în care sinapsele și circuitele neuronale afectate să recupereze parțial funcția înainte ca deteriorarea structurală să devină ireversibilă. Totuși, aceasta nu înseamnă că o terapie bazată pe NAD+ va funcționa singură pentru toți pacienții; este probabil ca răspunsul să varieze în funcție de stadiul bolii, profilul genetic (de ex. prezența alelei APOE4), comorbidități vasculare și alți factori biologici.
Căi posibile de urmat: studii clinice și controale de siguranță
Următorii pași includ muncă preclinică suplimentară pentru a confirma ferestrele de dozare, efectele pe termen lung și siguranța în funcție de vârstă și fundal genetic. Aceste studii pot include evaluări toxicologice extinse, studii farmacocinetice (cum se distribuie, metabolizează și elimină P7C3-A20 în organisme mai mari) și experimente în modele non‑rodent pentru a estima riscurile potențiale la om. Dacă rezultatele preclinice sunt încurajatoare, ar putea urma studii clinice umane atent proiectate — de obicei începând cu studii de fază I dedicate siguranței la voluntari sănătoși, urmate de faze inițiale la pacienți cu Alzheimer ușor până la moderat pentru a evalua tolerabilitatea și efectele preliminare asupra funcției cognitive și a biomarkerilor cerebrali.
O altă preocupare importantă este modul în care restaurarea NAD+ funcționează în contextul altor tratamente. Este posibil ca beneficiile să fie cele mai mari atunci când NAD+ este restabilit ca parte a unui regim combinat care țintește simultan inflamația, sănătatea vasculară (ex. factori de risc cardiovascular) și agregarea proteinelor (prin terapii anti‑amyloid sau anti‑tau aprobate sau în studii). Date fiind complexitatea și eterogenitatea bolii Alzheimer, strategiile multimodale — care combină neuroprotecția metabolică cu reducerea patologiei proteice și îmbunătățirea mediului vascular și imun — par plauzibile și rezonabile din punct de vedere științific.
Perspective ale experților
Dr. Lena Morales, o neurocercetătoare senior fictivă dar realistă de la o universitate majoră de cercetare, comentează: "Acest studiu schimbă modul în care privim reziliența creierului pe măsură ce îmbătrânim. În loc să ne concentrăm doar pe eliminarea fiecărui semn patologic, sporirea metabolismului celular și a sistemelor de reparare ar putea permite neuronilor să recupereze funcționalitatea — cel puțin temporar. Este o abordare încurajatoare și pragmatică care completează alte strategii terapeutice."
Pe lângă această perspectivă optimistă, specialiștii subliniază importanța transparenței datelor, replicării independente și a evaluării riguroase a efectelor adverse. Publicarea în Cell Reports Medicine (2025) permite accesul comunității științifice la detalii metodologice, rezultatele comportamentale și datele biomarkerilor, facilitând examinarea critică și reproducerea studiului — pași esențiali înainte de orice progres clinic semnificativ.
Deși persistă multe necunoscute, acest studiu oferă o cale testabilă și realistă: recalibrează economia energetică a creierului și ai putea debloca recuperarea chiar și în etapele avansate ale bolii. În plan practic, aceasta înseamnă că cercetarea viitoare ar trebui să includă evaluarea biomarkerilor NAD+, măsurători ale funcției mitocondriale, marcaje ale inflamației microgliale și teste cognitive sensibile la schimbările subtile ale memoriei și învățării.
În plus față de investigarea P7C3-A20, viitoarele eforturi științifice ar putea explora combinații cu precursorii NAD+ deja cunoscuți (de exemplu NR sau NMN), agenți antiinflamatori specifici creierului, sau terapii vasculare menite să optimizeze aportul de oxigen și nutrienți la nivelul țesutului neuronal. Evaluarea efectelor pe subgrupuri de pacienți — în funcție de genetică, stadiul bolii și comorbidități — va fi vitală pentru definirea populațiilor care ar putea beneficia cel mai mult de o astfel de intervenție.
În final, importanța acestui tip de cercetare stă nu doar în potențialul terapeutic direct, ci și în schimbarea paradigmei: de la abordări unice, țintite exclusiv asupra markerilor patologici, la strategii care întăresc capacitatea intrinsecă a creierului de a rezista și se reface. Aceasta oferă o perspectivă complementară și sinergică pentru dezvoltarea viitoare de tratamente pentru Alzheimer și alte boli neurodegenerative.
Sursa: sciencealert


Lasă un Comentariu