10 Minute
Două studii clinice extinse au arătat că semaglutidul — ingredientul activ din medicamente populare precum Ozempic, Wegovy și forma orală Rybelsus — nu încetinește declinul cognitiv la persoanele cu tulburare cognitivă ușoară (MCI) sau boală Alzheimer în stadii incipiente. Rezultatele atenuează optimismul anterior că un tratament pentru diabet și pentru scăderea în greutate ar putea oferi și protecție pentru creierul îmbătrânit. Această descoperire are implicații importante pentru cercetarea privind tratamentele neuroprotectoare și pentru planificarea viitoarelor studii clinice într-un domeniu în care speranțele pacientelor, familiilor și medicilor sunt mari.
What the trials tested and what they found
Studiile denumite evoke și evoke+ au recrutat aproape 3.800 de participanți cu vârste între 55 și 85 de ani, toți având fie tulburare cognitivă ușoară, fie Alzheimer în stadii incipiente. Pe parcursul a doi ani, voluntarii au primit zilnic semaglutid oral (Rybelsus) sau un placebo, într-un design randomizat, dublu-orb — standardul de aur pentru evaluarea eficacității și siguranței tratamentelor. Eșantionul mare și distribuția geografică largă a contribuit la robustețea metodologică, dar și la eterogenitatea populației studiate, ceea ce complică interpretarea efectelor potențiale în subgrupuri specifice.
Cercetătorii au evaluat performanța cognitivă și capacitatea funcțională în viața de zi cu zi folosind Clinical Dementia Rating Sum of Boxes (CDR‑SB), un scor compozit care reflectă abilitățile de gândire și competențele practice cotidiene. Pe lângă CDR‑SB, au fost utilizate teste standardizate pentru memorie, funcții executive și comportament, iar probe de lichid cefalorahidian (LCR) au fost analizate pentru niveluri ale proteinelor asociate Alzheimer, cum ar fi raportul amyloid-β42/40, proteina tau fosforilată (p-tau) și markerii ai neurodegenerării (de ex. NfL). De asemenea, în subcohorte s-au efectuat investigații imagistice (RMN, PET) pentru a corela modificările biologice cu structura și funcția cerebrală.
În ciuda unor modificări mici și consistente în anumite biomarkeri biologici — cum ar fi ușoare scăderi ale unor proteine din LCR sau semne de reducere a inflamației neurogliale — participanții care au primit semaglutid nu au înregistrat un avantaj clinic semnificativ față de placebo la principalele măsuri clinice. Funcțiile de memorie, abilitățile executive și capacitatea de a realiza activitățile zilnice au scăzut într-un ritm similar în ambele grupuri pe parcursul celor 24 de luni. Aceste rezultate sugerează o discrepanță între semnele biologice detectabile și efectele funcționale măsurabile în viața reală.
Scientific background: why semaglutide seemed promising
Semaglutidul este un agonist al receptorului GLP‑1 (peptidă‑1 asemănătoare glucagonului). GLP‑1 este un hormon eliberat în mod fiziologic după consumul de alimente și are roluri diverse în reglarea glicemiei — stimulează secreția de insulină dependentă de glucoză, reduce apetitul și încetinește evacuarea gastrică. Mecanismele metabolice ale GLP‑1 au atras atenția neurologilor pentru potențialele efecte cerebrale: activarea receptorilor GLP‑1 în sistemul nervos central poate reduce răspunsurile inflamatorii, susține metabolismul energetic neuronal și proteja celulele de stresul oxidativ și de disfuncția mitocondrială.
Studii preclinice, care au folosit culturi celulare și modele animale, au sugerat că semaglutidul poate acționa prin mai multe căi relevante pentru boala Alzheimer: reducerea neuroinflamației, îmbunătățirea semnalizării insulinice la nivel cerebral, susținerea funcției mitocondriale și potențialul de a limita acumularea plăcilor de amyloid și a încurcăturilor de tau. Observațiile epidemiologice la persoane cu diabet zaharat au indicat, de asemenea, o posibilă asociere între utilizarea agenților GLP‑1 și un ritm mai lent al declinului cognitiv, deși aceste studii observaționale sunt susceptibile la confounding și nu stabilesc cauzalitate.
Aceste semnale din laborator și din datele populaționale au creat un raționament plauzibil pentru testarea semaglutidului în stadii clinice timpurii ale Alzheimer: ipoteza era că un agent care îmbunătățește metabolismul neuronal și reduce inflamația ar putea întârzia progresia simptomelor cognitive. Totuși, tranziția de la modele animale la impact clinic la om rămâne o provocare majoră în neurologie și farmacologie.
Why the trials may have come up negative
Există mai multe explicații posibile pentru rezultatul negativ al acestor trialuri. În primul rând, momentul intervenției este esențial: strategiile neuroprotectoare sunt adesea mai eficiente înainte de apariția simptomelor sau în fazele preclinice ale bolii. Odată ce patologia amyloidă și tau devine semnificativă și are loc pierderea neuronală ireversibilă, intervențiile care vizează inflamația sau metabolismul pot avea un impact limitat asupra traiectoriei clinice.
În al doilea rând, modificările în biomarkeri nu se traduc întotdeauna în beneficii funcționale. O schimbare modestă în nivelurile de proteine din LCR poate indica un efect biologic, dar acesta ar putea fi prea mic, prea tranzitoriu sau nesincronizat cu circuitele neuronale critice pentru memorie și funcționare cotidiană, în special pe fereastra de observare de doi ani. Mai mult, unele efecte biologice pot necesita un interval de timp mai lung pentru a se traduce în ameliorări clinice detectabile.
În al treilea rând, boala Alzheimer este o condiție complexă și multifactorială: un singur medicament care acționează asupra căii GLP‑1 poate influența mai multe procese relevante, dar totuși să nu acopere alți factori critici ai declinului, cum ar fi patologiile vasculare, disfuncția sinaptică avansată sau mecanismele independente de amyloid/tau. În fine, pot exista subgrupuri de pacienți — definite prin factori genetici (de ex. portatori APOE4), comorbidități vasculare, mediul metabolic sau stadiul specific al patologiei — care ar putea beneficia, dar efectele lor se pot dilua atunci când datele sunt mediate la nivelul întregului eșantion.
Analizele ulterioare pe subgrupuri și datele complete vor fi esențiale pentru a evalua aceste ipoteze: de exemplu, persoanele cu diabet sau cu rezistență insulinică pot răspunde diferit comparativ cu cele fără disfuncție metabolică. De asemenea, doza, frecvența administrării și biodisponibilitatea la nivel central pot juca roluri — medicamentul oral Rybelsus trece mai greu bariera hemato‑encefalică decât variantele injectabile (Ozempic, Wegovy), iar aceasta ar putea influența eficacitatea neurologică.
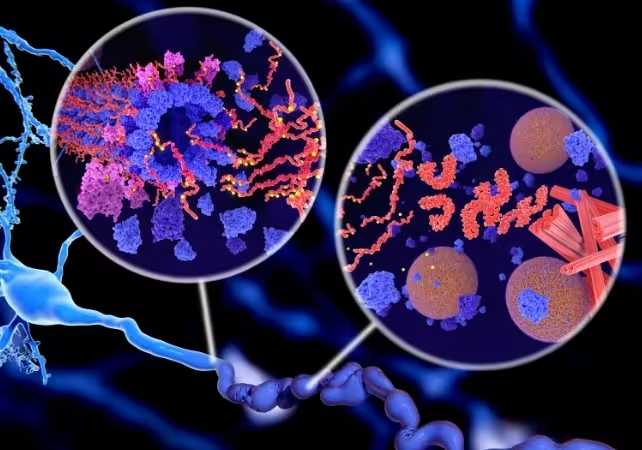
Agregatele proteinei tau pot determina moartea neuronală, contribuind la dezvoltarea bolii Alzheimer.
Trial rigor, safety and next steps
Trialurile evoke au fost globale, randomizate și controlate cu placebo, elemente care conferă încredere în validitatea rezultatului principal. Profilul de siguranță observat a fost compatibil cu ceea ce se știe despre semaglutid în indicații pentru diabet și pentru controlul greutății: efecte adverse gastrointestinale (greață, vărsături, diaree), modificări tranzitorii ale apetitului și, în unele cazuri, ușoare creșteri ale ritmului cardiac. Nu au apărut semnale noi de siguranță pe parcursul studiului care să contrazică datele existente din practicile clinice actuale.
Deoarece tratamentul nu a arătat un beneficiu clinic clar, compania farmaceutică Novo Nordisk a anulat planurile de prelungire a studiului pentru încă un an, decizie care reflectă pragurile riguroase pentru etică și resurse în cercetarea biomedicală. Cu toate acestea, analiza datelor brute, prezentarea seturilor de date complete și disecția subgrupurilor sunt planificate pentru conferințele internaționale de specialitate din 2026. Aceste prezentări vor fi cruciale pentru a înțelege dacă au existat efecte subtile într-un subset de pacienți, dacă modificările biologice au fost consecvente între participanți și dacă teste cognitive secundare au detectat ameliorări mici dar relevante.
Din perspectiva industriei farmaceutice și a cercetării clinice, aceste rezultate vor influența modul în care se proiectează studii viitoare care evaluează medicamente pentru pierdere în greutate sau antidiabetice în boala neurodegenerativă. Lecțiile pot include necesitatea intervenției la etape și mai timpurii (etapa preclinică), studii combinate care asociază agenți GLP‑1 cu terapii anti‑amyloid sau anti‑tau, și selecția mai precisă a pacienților pe baza biomarkerilor (imagistică PET, markeri LCR) și a profilului genetic pentru a maximiza șansele de a detecta un beneficiu real.
Expert Insight
„Aceste trialuri ne reamintesc că mecanismele promițătoare în laborator nu se traduc întotdeauna în beneficii clinice”, afirmă dr. Elena Morales, neurolog clinician și cercetătoare în neuroterapeutică. „Semaglutidul angajează mai multe procese legate de boala Alzheimer, dar modificarea acelor căi poate să nu fie suficientă odată ce simptomele clinice s-au instalat. Următorul pas este să testăm utilizarea mai timpurie, dozaje diferite sau combinarea agenților GLP‑1 cu terapii anti‑amyloid sau anti‑tau pentru a vedea dacă obținem un efect măsurabil.”
Dr. Morales subliniază, de asemenea, importanța designului studiilor viitoare: „Trebuie să definim clar populațiile țintă, să includem biomarkeri care justifică prezența patologiei Alzheimer și să evaluăm outcome‑uri care contează pentru pacienți și familii, nu doar modificări biochimice. Doar astfel vom putea converti promisiunile biologice în beneficii reale.”

Alți cercetători evidențiază valoarea studiilor cu rezultat negativ: ele restrâng aria ipotezelor plauzibile și rafinează direcțiile de cercetare. Înțelegerea motivelor pentru care un medicament biologic activ nu oferă beneficii clinice ajută la prioritizarea mecanismelor care merită urmărite în continuare și la identificarea grupurilor de pacienți care ar putea fi cele mai susceptibile la intervenție.
Conclusion
Rezultatele studiilor evoke și evoke+ temperă speranțele că semaglutidul va deveni o terapie pentru boala Alzheimer. Deși medicamentul influențează mai multe procese relevante pentru boală și a produs schimbări mici în biomarkeri, el nu a încetinit declinul cognitiv și nu a îmbunătățit funcționarea zilnică la persoanele cu boală simptomatică în stadii timpurii. Acest rezultat subliniază un decalaj frecvent între modelele celulare sau animale și neurobiologia umană complexă. Evidențiază, de asemenea, necesitatea urgentă a unor strategii noi: intervenții mai timpurii, terapii combinate (de ex. agenți GLP‑1 plus anticorpi anti‑amyloid/anti‑tau), optimizarea dozelor și o selecție precisă a pacienților pe baza biomarkerilor și a profilului genetic. Numai prin astfel de abordări integrate există șansa reală de a transforma promisiunile biologice în beneficii măsurabile pentru persoanele și familiile afectate de boala Alzheimer.
Sursa: sciencealert

Lasă un Comentariu