10 Minute
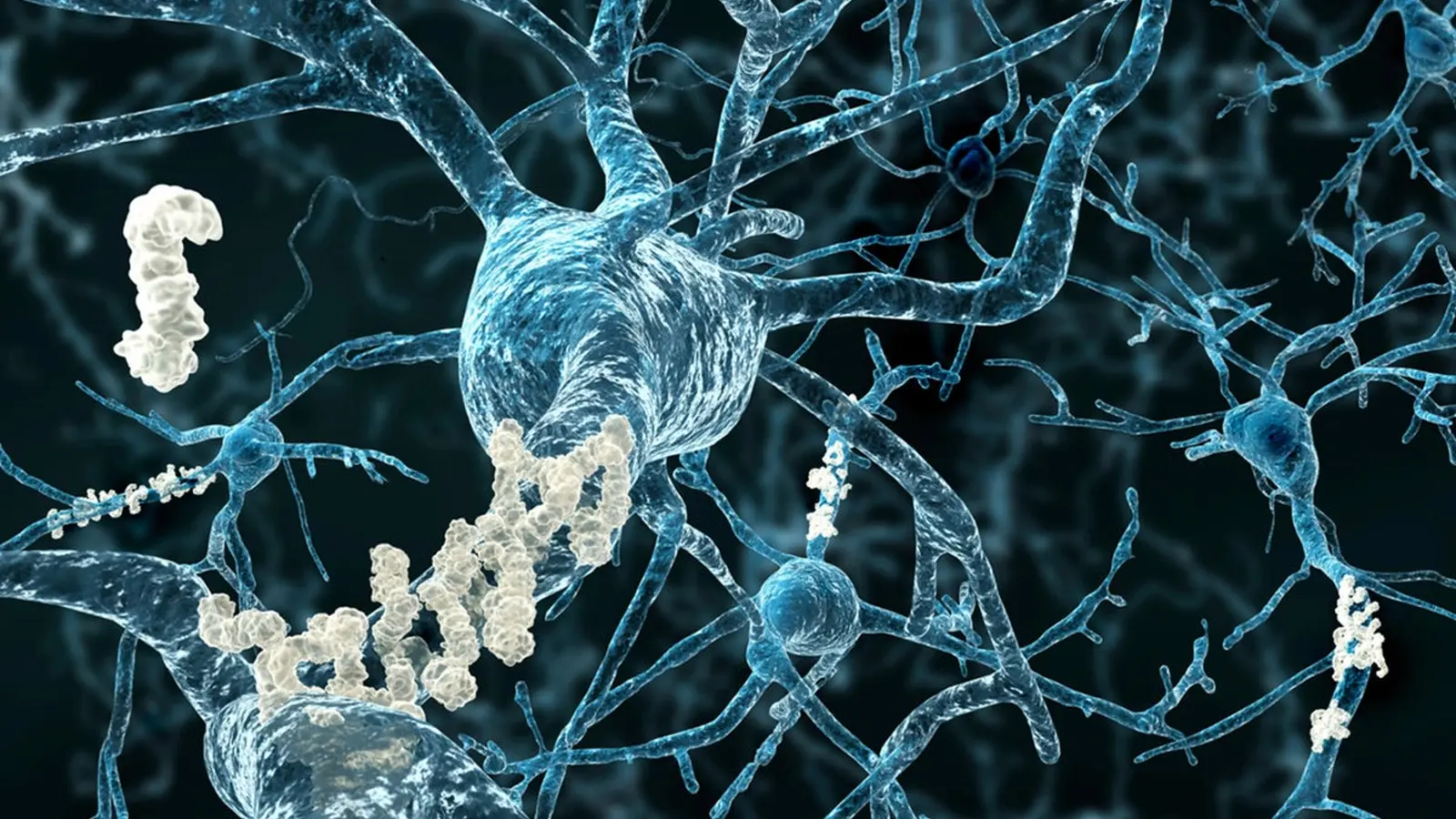
Cercetătorii de la Baylor College of Medicine au descoperit un mecanism înnăscut surprinzător pe care creierul îl poate folosi pentru a ataca patologia Alzheimer. Prin creșterea nivelurilor unei proteine regulatorii numite Sox9, oamenii de știință au activat celule de sprijin în formă de stea, cunoscute sub numele de astrocite, și le-au transformat în curățitoare puternice ale plăcilor amiloide — depozitele proteice lipicioase asociate de mult timp cu pierderea memoriei.
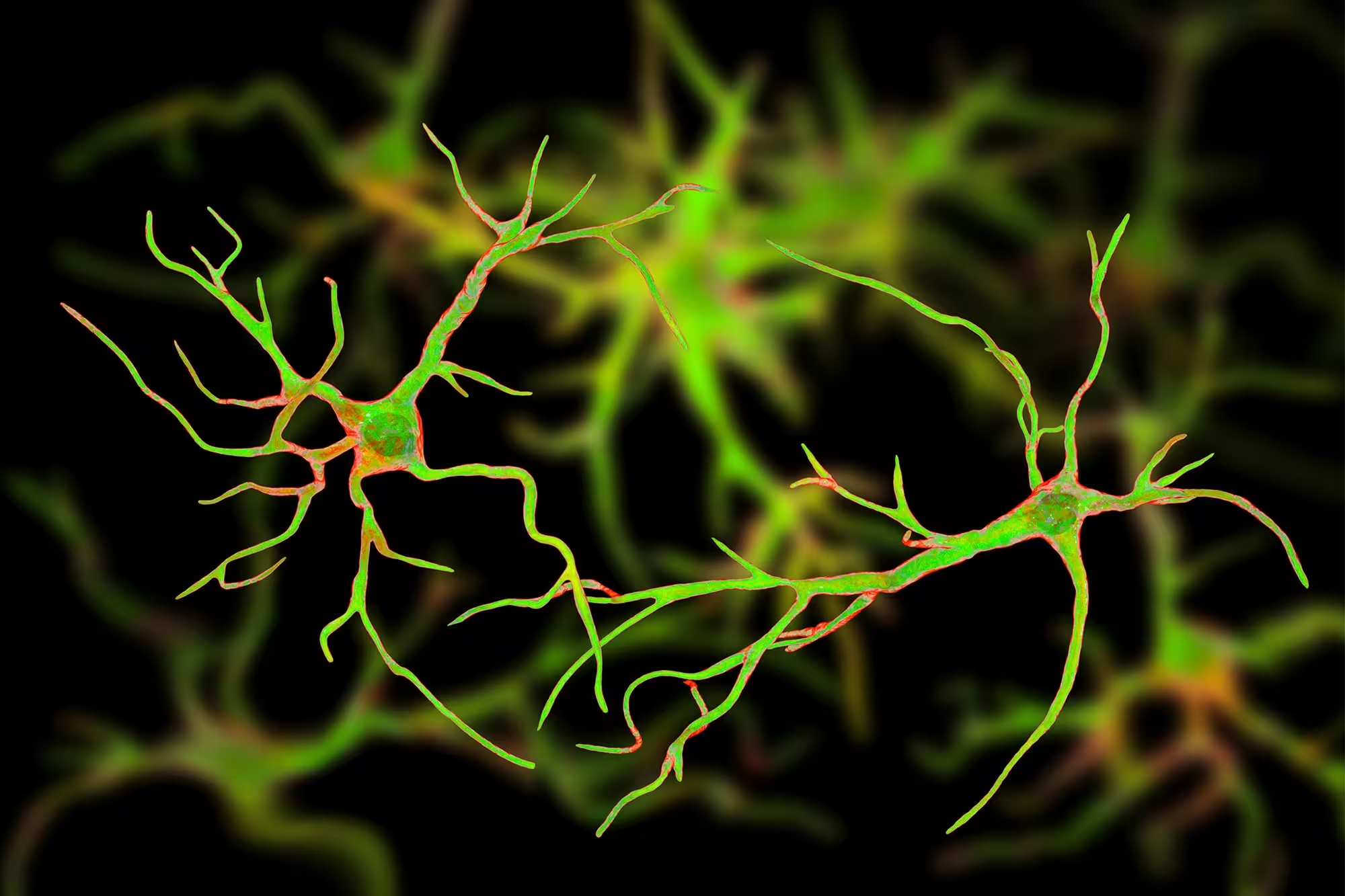
Creșterea nivelului de Sox9 activează capacitatea naturală a astrocitelor de a curăța plăcile amiloide și de a proteja funcția cognitivă. Rezultatele indică o abordare terapeutică complet nouă pentru boala Alzheimer, centrată pe celulele de sprijin ale creierului, nu pe neuroni.
Astrocitele: gospodarii neglijați ai creierului
Astrocitele sunt celule gliale care fac mult mai mult decât să mențină integritatea structurală a creierului: ele reglează nivelurile neurotransmițătorilor, susțin sinapsele și contribuie la menținerea mediului chimic de care neuronii au nevoie pentru a funcționa. Aceste funcții includ captarea glutamatului pentru a preveni excitotoxicitatea, tamponarea ionilor precum potasiul, furnizarea de substraturi energetice neuronilor și sprijinul pentru formarea și eliminarea sinapselor. În plus, astrocitele participă la sistemul glinfatic, un mecanism de clearance interstițial care ajută la evacuarea deșeurilor proteice din parenchimul cerebral.
În procesul de îmbătrânire și în bolile neurodegenerative, astrocitele își modifică comportamentul și expresia genică, adesea adoptând fenotipuri reactive care pot fi fie protective, fie dăunătoare. Până acum, potențialul lor de a elimina activ plăcile amiloide existente a fost subestimat, iar cercetările recente care vizează fenotipurile astrocitare deschid noi perspective pentru terapii axate pe glie.
Importanța astrocitelor în boala Alzheimer și în sănătatea creierului subliniază necesitatea unor terapii care nu doar să vizeze neuronii, ci și să corecteze disfuncțiile gliale. Termeni-cheie pentru această zonă includ astrocite, Sox9, clearance amiloid și terapie neurodegenerativă.
Ce este Sox9 și de ce contează
Sox9 este un factor de transcriere — o proteină care controlează activitatea multor gene. Factorii de transcriere coordonează programe genice complexe, declanșând sau reprimând rețele de gene implicate în dezvoltare, diferențiere celulară și răspunsuri stres. În creierul îmbătrânit, Sox9 pare să acționeze ca un regulator principal pentru funcții critice ale astrocitelor.
Modularea Sox9 poate influența expresia genelor implicate în fagocitoză, funcția lizozomală, remodelarea citoscheletală și secreția de molecule semnalizatoare. Prin urmare, creșterea sau scăderea expresiei Sox9 schimbă starea funcțională a astrocitelor: de la o formă mai simplă și mai puțin activă la o formă mai complexă, cu procese ramificate și capacitate crescută de internalizare a fragmentelor proteice precum amyloid-beta.
Pe plan mecanic, Sox9 ar putea regla direct sau indirect transmisia semnalelor care controlează receptori de recunoaștere a particulelor extracelulare, proteine implicate în fusionele endozomale și gene care mãresc capacitatea de degradare lizozomală. Înțelegerea rețelelor moleculare descendente ale Sox9 (de exemplu, targeturi TF, co-regulatori, căi endolizozomale) este esențială pentru transformarea acestei descoperiri într-o strategie terapeutică sigură și eficientă.
How the experiment worked: testing Sox9 in mice with symptoms
Echipa de la Baylor s-a concentrat pe modele murine de Alzheimer care prezentau deja declin cognitiv și acumulare de plăci amiloide, ceea ce crește relevanța pentru boala umană, unde patologii sunt adesea bine instalate la debutul simptomelor. Întrebarea cheie nu a fost prevenția formării plăcilor, ci dacă plăcile deja existente pot fi eliminate și dacă acest proces poate conserva funcția cognitivă.
Cercetătorii au folosit instrumente genetice pentru a modifica expresia Sox9 specific în astrocite: fie au supraprodus Sox9 în aceste celule, fie au eliminat expresia sa (knockout condiționat). Abordări tipice pentru astfel de experimente includ utilizarea unor linii transgenice cu promotori specifici astrocitelor și sisteme inducibile (de exemplu, Cre-lox) pentru a controla timpul și localizarea modificării exprimate. În unele studii similare se utilizează vectori virali, cum ar fi AAV, pentru livrarea selectivă a genei în populații gliale.
Pe durata experimentului, animalele au fost urmărite timp de șase luni și evaluate prin baterii comportamentale care măsoară memoria și recunoașterea obiectelor și a mediilor familiare (de ex., testul de recunoaștere a obiectului nou, Morris water maze pentru orientare spațială, sau alte teste de memorie dependentă de hipocamp). După faza comportamentală, creierele au fost analizate histologic pentru a cuantifica încărcătura de plăci (folosind anticorpi specifici pentru amyloid-beta și coloranți precum Thioflavin S), precum și pentru a evalua morfologia și activitatea astrocitelor (marcatori cum ar fi GFAP și analize morfometrice ale ramificării).
Metode complementare au inclus microscopie confocală pentru co-localizarea astrocitelor cu zonele de acumulare amiloidă, analiza expresiei genice prin RT-qPCR sau secvențiere de tip RNA-seq pentru a identifica genele reglate de Sox9 și testele biochimice pentru a măsura nivelele totale de amyloid-beta solubil și insolubil.
Key discovery: Raising Sox9 reverses plaque build-up and memory loss
Rezultatele au urmat un model clar și consecvent. Reducerea expresiei Sox9 a accelerat acumularea plăcilor, a simplificat structura astrocitelor și a redus capacitatea acestor celule de a elimina amyloidul. În contrast, supraexprimarea Sox9 a determinat astrocite mai complexe și mai active; aceste celule au ingerat mai mult amyloid, au redus încărcătura de plăci și — aspect esențial — au păstrat performanța cognitivă la șoarecii care anterior prezentaseră deficite.
În termeni practici, creșterea Sox9 a transformat astrocitele într-o echipă de curățenie mai eficientă, reducând un semn patologic al bolii Alzheimer și încetinind declinul membral observat în modelele animale. Aceasta sugerează o strategie terapeutică complementară abordărilor axate pe neuroni sau pe blocarea formării plăcilor, prin valorificarea capacității endogene de clearance a creierului.
Din punct de vedere mecanic, datele indică faptul că Sox9 poate upregula gene asociate fagocitozei, transportului endozomal și degradării lizozomale, precum și elemente ce influențează plasticitatea morfologică a astrocitelor. Totodată, modificările în comunicarea dintre astrocite și microglia sau neuronii pot juca un rol cheie în eficacitatea clearance-ului amiloidic.
Therapeutic promise and necessary cautions
Aceste descoperiri deschid o nouă direcție terapeutică: în loc să ne concentrăm exclusiv pe blocarea formării plăcilor sau pe protejarea neuronilor, în viitor tratamentele ar putea stimula astrocitele pentru a elimina depozitele amiloide existente. Având în vedere că astrocitele sunt numeroase și îndeplinesc numeroase roluri în homeostazia creierului, țintirea lor ar putea aduce efecte largi — atât benefice, cât și potențial riscante.
Cercetătorii subliniază mai multe precauții importante. Datele curente provin din modele murine: creierul uman are o complexitate mai mare, o arhitectură diferențiată a gliei și un curs temporal al bolii diferit. Consecințele pe termen lung ale stimulării artificiale a Sox9 rămân necunoscute; suprastimularea celulelor gliale poate genera uneori inflamație cronică, fenotipuri reactive care afectează sinapsele sau disfuncții secundare în metabolismul cerebral. De exemplu, existența fenotipurilor astrocitare de tip A1 (potențial neurotoxice) versus A2 (potențial protectoare) impune o atenție deosebită pentru a nu induce răspunsuri dăunătoare.
Alte provocări practice includ metoda de livrare (virală — AAV serotipuri compatibile cu traversarea barierii hematoencefalice, injecții intraparenchimale sau intratecale, nanoparticule), selectivitatea țintirii astrocitelor, doza optimă, controlul temporal al expresiei Sox9 și monitorizarea efectelor off-target. În plus, orice intervenție trebuie evaluată pentru impactul asupra interacțiunilor dintre astrocite, microglia și neuroni, precum și asupra sistemului imunitar periferic.
Pentru a avansa spre aplicații clinice sunt necesare studii preclinice extinse în modele non-umane, analize pe țesut uman ex vivo și, în final, studii clinice bine concepute care să monitorizeze biomarkeri de siguranță (inflamație, markeri gliali), biomarkeri de eficacitate (PET amiloid, Aβ în LCR/plasmă, p-tau) și evaluări cognitive standardizate.
Related science and future directions
Acest studiu intersectează un interes tot mai mare pentru biologia glială, neuroimunologie și terapii bazate pe reglarea expresiei genice. Tehnici precum vectorii virali (de ex., AAV), molecule mici care modulează factori de transcripție, terapii de tip CRISPRa pentru activarea genelor endogene sau editare genică ar putea fi adaptate pentru a regla activitatea Sox9. De asemenea, abordări non-genetice, ce vizează căi de semnalizare care activează Sox9 sau efectele sale downstream, pot reprezenta alternative cu un profil de risc diferit.
Întrebări critice pentru viitor includ: când este momentul optim pentru intervenție (etape prodromale vs. stadii moderate), cum se pot combina terapiile care stimulează astrocitele cu alte strategii (de exemplu, anticorpi anti-amyloid sau terapii anti-tau) și care sunt biomarkerii cei mai utili pentru a măsura răspunsul la tratament. Proiectarea de studii combinaționale și abordări personalizate, în funcție de fenotipuri clinice și biomarkerii pacienților, ar putea crește șansele de succes clinic.
De asemenea, integrarea datelor din transcriptomica celulelor unice (single-cell RNA-seq) va ajuta la cartografierea heterogenității astrocitelor și la identificarea subpopulațiilor care răspund favorabil la activarea Sox9. Această hartă moleculară poate ghida strategii terapeutice mai precise și poate minimiza riscul de efecte adverse.
Expert Insight
"Lucrarea de la Baylor evidențiază o paradigmă în schimbare: celulele de sprijin nu sunt spectatori pasivi în neurodegenerare," spune dr. Emily Saunders, neurobiolog la Institute for Brain Health. "Dacă putem valorifica în siguranță mecanismele endogene de clearance ale astrocitelor, ar putea completa abordările existente și oferi o cale de reducere a patologiei chiar și după apariția simptomelor. Provocarea este acum să traducem aceste modificări la nivel de genă în terapii care sunt eficiente și sigure la oameni."
Comentariile experților subliniază necesitatea unor eforturi multidisciplinare, combinate — biologie moleculară, farmacologie, neurologie clinică și inginerie biomedicală — pentru a transforma descoperiri precum cele despre Sox9 și astrocite în intervenții viabile în practica clinică.
Pe scurt, studiul adaugă o piesă importantă în puzzle-ul bolii Alzheimer. Sugerează că creierul ar putea avea deja instrumente proprii pentru a lupta împotriva patologiei — trebuie doar să învățăm cum să le activăm controlat, fără a provoca efecte secundare nedorite. Pe măsură ce cercetătorii descompun efectele downstream ale Sox9 și testează strategii de translație, conceptul terapiilor bazate pe astrocite trece de la speculație la fezabilitate.
Pentru pacienți și îngrijitori, aceste rezultate nu schimbă încă îngrijirea clinică. Totuși, ele extind harta țintelor terapeutice și consolidează ideea că tratamentele eficiente pentru Alzheimer vor necesita probabil o abordare multiplu-front: protejarea neuronilor, limitarea răspândirii proteinelor toxice și activarea sistemelor naturale de curățare ale creierului, inclusiv prin modularea Sox9 și a funcției astrocitice.
Sursa: scitechdaily

Lasă un Comentariu