9 Minute
Noi cercetări indică faptul că boala Alzheimer poate afecta "ceasurile" genetice de 24 de ore din celulele de susținere ale creierului, modificând momentele când genele-cheie asociate riscului sunt activate sau opri te. Această perturbare ar putea schimba modul în care creierul elimină proteinele toxice și menține funcții neuronale zilnice — deschizând o cale nouă pentru posibile terapii legate de ritmurile circadiene și sănătatea creierului.
Ce au analizat cercetătorii și de ce contează
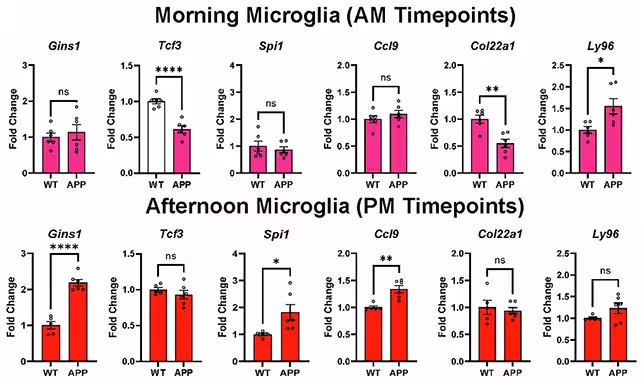
Cercetătorii de la Washington University School of Medicine au comparat activitatea genelor pe parcursul zilei în creierele unor șoareci sănătoși și ale unor șoareci modificați genetic pentru a dezvolta plăci de amiloid asemănătoare celor din boala Alzheimer. Studiul s-a concentrat pe două tipuri de celule non-neuronale: astrocitele, care oferă suport metabolic și structural neuronilor, și microglia, celulele imune rezidente responsabile cu curățarea resturilor celulare. Echipa a verificat apoi aceste rezultate și pe țesut uman cerebral pentru a valida relevanța constatările la om.
Conceptul central al studiului este ritmul circadian — sistemul intern de temporizare care coordonează somnul, metabolismul și multe sarcini celulare pe un ciclu de aproximativ 24 de ore. Deși perturbările circadiene au fost de mult timp asociate cu demența și tulburările de somn la pacienți, această lucrare detaliază cum oscilațiile zilnice ale expresiei genice se modifică în interiorul unor tipuri specifice de celule cerebrale în contextul bolii.
Metodologic, studiul a folosit tehnici de transcriptomică și secvențiere ARN pe celulă unică (single-cell RNA-seq) pentru a surprinde variațiile temporale ale transcriptelor în microglie și astrocite. Această abordare permite a vedea care gene prezintă un ritm zilnic clar (oscilații circadiene) și cum aceste ritmuri suferă modificări în prezența patologiei Alzheimer. Astfel s-au obținut detalii despre mecanismele moleculare care leagă ceasurile moleculare (de exemplu genele ceasului precum BMAL1, CLOCK, PER și CRY) de funcțiile imune și de homeostazie în creier.
Descoperiri cheie: care gene sunt prinse în ceas
Dintre cele 82 de gene anterior asociate cu riscul de Alzheimer, investigatorii au constatat că aproximativ jumătate prezintă reglare circadiană în celule gliale. Cu alte cuvinte, activitatea multor gene legate de Alzheimer crește și scade conform unui program zilnic în creierele sănătoase — ritmuri care sunt alterate în modelul de boală.
Urmărirea expresiei genice în microglie pe parcursul zilei a arătat schimbări pronunțate în prezența patologiei Alzheimer. Aceste modificări dependente de ceas ar putea influența modul în care glia îndeplinește sarcini fundamentale, precum clearance-ul peptidei amiloid-β (amyloid-β) și reglarea inflamației — funcții esențiale pentru menținerea unui mediu cerebral curat și funcțional.
Schimbările identificate nu sunt doar statistice: ele se corelează cu alterări funcționale raportate anterior în modele animale și în țesut uman, incluzând variații în fagocitoză, secreția citokinelor și răspunsul metabolic. Astfel, ritmurile circadiene ale genelor implicate în imunitate și metabolizare pot avea impact direct asupra capacității creierului de a gestiona acumularea de proteine patologice.
Către ce direcție merge cauzalitatea?
O întrebare esențială rămâne fără răspuns definitiv: acumularea de amiloid perturbă ceasurile celulare, sau un ceas slăbit crește riscul formării plăcilor? Cercetătorii înclină spre ideea că modificarea temporizării circadiene în tipuri celulare specifice contribuie la progresia bolii, dar relația este probabil bidirecțională — biologia bolii și funcția ceasului se pot amplifica reciproc.
Există argumente experimentale pentru ambele direcții: pe de o parte, agregarea proteinei amiloid-β și a proteinei tau poate induce stres celular care interferează cu mecanismele moleculare ale ceasului; pe de altă parte, dereglarea genelor ceasului (de exemplu pierderea expresiei funcționale a BMAL1) este asociată experimental cu fenotipuri pro-inflamatorii și cu scăderea capacității de curățare a toxinei în modele animale. Clarificarea secvenței cauzale este un pas cheie pentru a proiecta intervenții eficiente.
De ce contează sincronizarea pentru curățarea creierului și simptome
Aproximativ 20% din genele umane oscilează în ritm circadian, guvernând procese de la digestie la repararea țesuturilor. Dacă ceasurile gliale se dereglează, sincronizarea mecanismelor de clearance al deșeurilor, supraveghere imună și suport metabolic se poate schimba — ceea ce conduce la eliminare ineficientă a proteinelor toxice și la o vulnerabilitate crescută la neurodegenerare.
Din punct de vedere clinic, perturbarea ritmurilor circadiene se manifestă în moduri ușor de recunoscut. Pacienții cu Alzheimer prezintă frecvent fragmentarea somnului și agravarea confuziei spre sfârșitul zilei, un fenomen denumit "sundowning". Noile dovezi moleculare leagă aceste simptome de modificări tangibile în reglarea genică în celulele responsabile de curățenie și imunitate în creier.
Mai mult, mecanisme de eliminare a proteinelor, precum sistemul glicfatic (glymphatic) — activ în mare parte în timpul somnului — pot fi afectate de schimbări în ritmurile celulare. Dacă astrocitele și microglia nu sunt sincronizate cu ciclul somn-veghe, fluxurile interstițiale și procesele de drenaj pot suferi, scăzând eficiența îndepărtării amiloidului și a altor metaboliți nocivi.
Posibilități terapeutice: repornirea ceasurilor cerebrale
Abordări practice pot include agenți farmacologici care țintesc proteinele de bază ale ceasului (de exemplu modulatoare ale REV-ERBα sau ROR), administrarea sincronizată a medicamentelor existente (cronoterapie), sau intervenții în stilul de viață — expunerea la lumină la ore fixe, programarea somnului și a meselor — care întăresc ritmurile sănătoase la nivel sistemic.
În plus, terapiile combinate care vizează atât reducerea agregării proteinelor (de exemplu anticorpi monoclonali anti-amiloid) cât și restabilirea ritmurilor circadiene ar putea avea un efect sinergic. De exemplu, administrarea unui tratament anti-amiloid la un moment al zilei în care microglia are capacitate maximă de fagocitoză ar putea crește eficiența eliminării.
Studiile preclinice sugerează că țintirea genelor ceasului poate modula comportamentul imunitar al microgliei: activarea anumitor componente ale ceasului molecular reduce răspunsul inflamator excesiv, în timp ce restabilirea ritmurilor poate îmbunătăți capacitatea de curățare a resturilor proteice. Traducerea acestor rezultate în terapii umane necesită testări riguroase de siguranță și studii clinice bine concepute.
Ce urmează în cercetare și tratament
Studiul deschide multiple direcții experimentale: determinarea legăturilor cauzale între perturbarea ceasului și acumularea plăcilor, testarea dacă resetarea ceasurilor gliale inversează patologia în modele animale, și traducerea intervențiilor bazate pe temporizare în primele studii clinice sigure.
Experimente viitoare ar trebui să includă: manipulări genetice țintite ale componentelor ceasului molecular în microglie și astrocite pentru a evalua efectele asupra acumulării de amiloid; studii cronobiologice care să determine ferestrele temporale în care terapia este mai eficientă; și trialuri longitudinale la pacienți cu tulburări de somn sau cu stadii precoce de boală pentru a testa intervenții non-farmacologice precum terapia cu lumină sau ajustarea orelor de masă.
Optimizarea biologiei circadiene poate completa strategiile tradiționale orientate spre reducerea agregării proteinelor sau spre modularea răspunsului imun. Un cadru integrat care include evaluarea ritmurilor biologice ca biomarkeri (de exemplu prin măsurarea expresiei genice circadiene, a modelelor de somn sau a markerilor metabolici) poate ajuta la personalizarea tratamentelor în funcție de profilul temporal al fiecărui pacient.
Perspectiva expertă
"Această lucrare reconfigurează parțial ideea că Alzheimer este doar o boală a deteriorării moleculare, arătând că este, în egală măsură, o boală de sincronizare," spune Dr. Lydia Farrow, neuroimunolog fictiv specializat în neuroștiințe circadiene. "Dacă putem învăța să reglăm temporizarea activității genice în microglie și astrocite, am putea păstra funcțiile de întreținere ale creierului suficient de mult timp pentru a încetini sau preveni degenerarea ulterioară."
Studiul, publicat în Nature Neuroscience, se bazează pe dovezi în creștere că ceasurile noastre interne sunt strâns legate de sănătatea cerebrală. Prin cartografierea genelor de risc pentru Alzheimer care cresc și scad în ritmul zilei, cercetătorii au evidențiat un strat nou de biologie care ar putea fi crucial pentru intervențiile timpurii.
Pe termen lung, integrarea datelor despre ritmurile circadiene cu biomarkerii existenți (de exemplu imagistica PET pentru amiloid, biomarkeri în lichidul cefalorahidian și teste cognitive) va permite o abordare mai nuanțată și orientată pe momentul administrării intervențiilor. Această sinergie între cronobiologie și neurologie poate oferi oportunități reale pentru prevenție, diagnostic precoce și tratamente personalizate în boala Alzheimer.
În concluzie, deși sunt necesare multe studii suplimentare pentru a stabili cauzalitatea și pentru a testa eficacitatea intervențiilor bazate pe timp, direcția este promițătoare. Reîntregirea sau re-sincronizarea ceasurilor celulare din astrocite și microglie reprezintă o abordare inovatoare care ar putea extinde arsenalul terapeutic împotriva Alzheimer, integrând știința ritmurilor biologice cu strategiile convenționale anti-aggregare și antiinflamatorii.
Sursa: sciencealert


Lasă un Comentariu