9 Minute
Imaginează-ți un soldat din linia întâi care, dacă este capturat, înghite o grenadă decât să trădeze pozițiile inamicului. Aceasta este alegerea radicală pe care par să o facă unele celule imunitare din creier atunci când se confruntă cu parazitul Toxoplasma gondii: declanșează propria moarte pentru a împiedica invadatorul să le folosească ca vehicul de transport.
Celulele T — în special submulțimea CD8+ — sunt cunoscute mai ales pentru capacitatea lor de a vâna celulele infectate și de a semnaliza întăriri. Cercetătorii de la Universitatea din Virginia au descoperit însă o manevră defensivă mult mai extremă. Când aceste celule T sunt infectate de T. gondii, ele pot iniția moartea programată a celulei, o acțiune care distruge locul în care parazitul se ascunde și oprește răspândirea ulterioară prin țesutul neuronal.
Cum un comutator molecular forțează un sacrificiu decisiv
În centrul acestui răspuns suicidar se află o enzimă numită caspază-8 (caspase-8). În biologia celulară, caspaza-8 este deja legată de căi de moarte celulară programată, dar rolul său specific în interiorul celulelor CD8+ atunci când se confruntă cu T. gondii nu fusese clarificat până la acest studiu. Echipa de cercetare a folosit șoareci modificați genetic pentru a elimina caspaza-8 din populații celulare țintite. Rezultatul a fost clar: atunci când celulele CD8+ erau lipsite de caspaza-8, parazitul s-a răspândit mult mai ușor în țesutul cerebral, în ciuda unei activități imunitare care părea robustă în rest.
Această constatare sugerează o logică simplă, dar puternică. Toxoplasma supraviețuiește trăind în interiorul celulelor gazdă. Dacă o celulă purtătoare moare înainte ca parazitul să-și finalizeze ciclul de viață, patogenul își pierde nișa. Caspaza-8 acționează ca un buton molecular de autodistrugere, care este apăsat atunci când este detectată infecția în celula T. Fără acest buton, parazitul uneori primește o „plimbare” — un cal troian — spre interiorul sistemului nervos central.
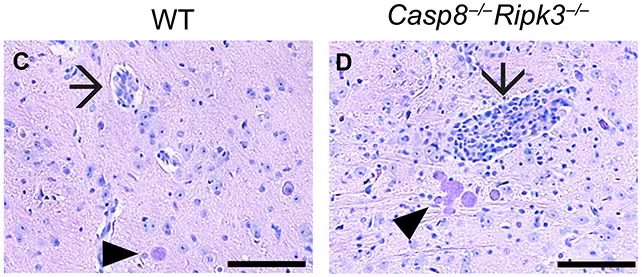
Patru săptămâni după infecție, șoarecii fără caspaza-8 (dreapta) prezentau niveluri mai ridicate de inflamație comparativ cu animalele care aveau caspaza-8 (stânga). Săgețile indică vase de sânge inflamate, iar vârfurile săgeților indică chisturi de T. gondii. (Sibley et al., Sci. Adv., 2025)
Designul experimentului și ce au arătat șoarecii
Cercetătorii au comparat grupuri de șoareci proiectați genetic să nu aibă caspaza-8 în diferite tipuri celulare cu animale de control care aveau funcția normală a caspazei-8. În aceste teste, T. gondii a invadat și a format chisturi în creier mult mai extins atunci când celulele CD8+ nu puteau executa programul de moarte dependent de caspaza-8. Este important de subliniat că markerii inflamatori și alte răspunsuri imunitare rămâneau puternici în acele animale, evidențiind faptul că pierderea protecției nu era cauzată de un sistem imunitar global mai slab, ci de absența acestei tactici defensive specifice.
De ce contează acest lucru dincolo de un detaliu curios al imunologiei? Pentru că patogenii care infectează persistent celulele trebuie fie să tolereze, fie să depășească căile gazdei care duc la moartea celulară. Cercetătorii propun că numai microbii capabili să interfereze cu caspaza-8 — blocând activarea ei sau efectele sale ulterioare — ar putea exploata celulele CD8+ ca vehicule. Aceasta poate explica de ce T. gondii pare să încerce această „trucare” doar rar: în majoritatea cazurilor, sacrificiul celulei T supraviețuiește agresiunii.
Mai tehnic, există mai multe forme de moarte celulară programată — apoptoza, necroptoza, piroptoza — și caspaza-8 este o componentă cheie care influențează aceste căi sau interacționează cu ele. De exemplu, când caspaza-8 activează cascada apoptotică în cadrul unei limfocite CD8+, celula se dezintegră în mod ordonat și elimină compartimentele în care parazitul ar putea rămâne viabil. Dacă această declanșare este împiedicată, parazitul are mai multe șanse să supraviețuiască eliberării celulare și să infecteze alte celule din țesutul cerebral.
Semnificația biologică și relevanța pentru sănătate publică
T. gondii infectează majoritatea animalelor cu sânge cald și poate persista silențios în creierul uman timp de ani. Estimările sugerează că zeci de milioane de persoane în Statele Unite poartă parazitul în mod asimptomatic; ratele reale variază în funcție de regiune, practici alimentare și factori socioeconomici. Pentru persoanele sănătoase, infecția primară adesea nu provoacă simptome evidente sau declanșează o boală ușoară. Însă pentru femeile însărcinate și pacienții imunodeprimați, mizele sunt mult mai mari: toxoplasmoza poate conduce la complicații severe, inclusiv leziuni congenitale ale fătului sau infecții care pun viața în pericol la cei cu imunitate compromisă.
Gândiți-vă la acest mecanism ca la o strategie de barieră celulară: în loc să permită patogenului să se instaleze și să călătorească în corp, celula infectată se „redă” pentru a limita oportunitățile invadatorului. Această constatare oferă o explicație plauzibilă pentru cât de frecvent infecțiile rămân latente și controlate în persoanele cu sistem imunitar funcțional — un echilibru delicat între eliminare și „negare” a spațiului de replicare pentru parazit.
Implicații pentru tratamente și știința imună
Translatarea acestei descoperiri în terapii va necesita prudență. Rezultatele actuale sunt preclinice și provin din modele la șoareci; biologia imunitară umană are diferențe importante care trebuie clarificate prin studii suplimentare. Totuși, identificarea caspazei-8 ca pivot al controlului mediat de celulele T deschide mai multe direcții: diagnostic mai bun pentru infecțiile cerebrale latente, strategii de protecție pentru pacienții vulnerabili și chiar medicamente țintite care ar putea imita sau amplifica acest comportament auto-limitant al celulelor T infectate.
În termeni practici, câteva direcții posibile includ:
- Dezvoltarea de markeri diagnostici care să detecteze disfuncția căilor caspazei-8 în probele cerebrale sau periferice.
- Strategii terapeutice care să protejeze sau să stimuleze capacitatea celulelor T de a executa moartea programată atunci când sunt invadate, fără a provoca o pierdere excesivă a imunității sistemice.
- Identificarea moleculelor patogenului care pot inhiba caspaza-8, pentru a proiecta inhibitorii sau vaccinurile care previn subversiunea acelor mecanisme.
Totodată, munca consolidează înțelegerea funcției celulelor CD8+ dincolo de omorârea citotoxică clasică și semnalizarea prin citokine. Arată că imunitatea nu este doar despre eliminarea invadatorilor, ci și despre a le refuza oportunități. Uneori, cea mai eficientă apărare este o decizie necompromisă de a arde podul din urmă.
Perspective experimentale și limitări
Există câteva puncte tehnice importante pe care cititorii și practicienii trebuie să le aibă în vedere. Modelele murine sunt instrumente esențiale în imunologie, dar nu reproduc integral complexitatea răspunsurilor umane — diferențele pot apărea în expresia receptorilor de suprafață, în profilurile citokinice sau în reglementarea enzimatică a căilor apoptotice. De asemenea, manipulările genetice care elimină complet caspaza-8 pot avea efecte compensatorii pe termen lung în dezvoltarea sistemului imunitar al animalelor, astfel că interpretarea rezultatelor necesită controale riguroase și replicare independentă.
Viitoarele studii ar trebui să includă:
- Analize funcționale în celule umane ex vivo, pentru a testa dacă mecanismele observate la șoareci sunt conservate la om.
- Studii care identifică factorii moleculari ai T. gondii care ar putea contracara caspaza-8 și modul în care aceștia interacționează cu proteinele gazdei.
- Investigații asupra echilibrului între beneficiul limitării răspândirii parazitare și riscul distrugerii excesive a țesutului cerebral prin activarea în exces a morții celulare.
Expertă în domeniu
„Descoperirea schimbă modul în care gândim despre patogenii intracelulari și compromisurile imune,” spune dr. Lena Ortiz, imunolog neimplicat în studiu. „Moartea mediată de caspaza-8 în celulele CD8+ este o strategie bruta, dar eficientă de conținere. Pasul următor este cartografierea modului în care patogenii care evită acest mecanism operează — acea cunoaștere va indica terapii care fie consolidează decizia celulei de a muri, fie previn subversiunea procesului de către patogen.”
Opinia expertă subliniază o realitate practică: în timp ce mecanismele de protecție celulare pot fi exploatate pentru beneficii clinice, intervențiile trebuie calibrate astfel încât să nu compromită rezerva imunitară a pacientului. În cazul bolilor care implică creierul, menținerea integrității țesutului și prevenirea inflamației nespecifice sunt obiective cruciale.
Concluzii și direcții viitoare
Studiul oferă o explicație mecanistică plauzibilă pentru de ce majoritatea infecțiilor cu T. gondii rămân silențioase la persoanele sănătoase: atunci când celulele imune detectează infiltrația, ele sunt uneori dispuse să se sacrifice în loc să permită unui parazit intracelular să-și croiască un drum. Dacă cercetările viitoare confirmă mecanisme similare la oameni, medicii ar putea într-o zi valorifica această cunoaștere pentru a proteja cei mai vulnerabili și pentru a proiecta intervenții care să controleze infecțiile persistente păstrând în același timp țesutul cerebral delicat.
Pe plan practic, integrarea acestor descoperiri într-o abordare clinică ar putea însemna combinații de diagnostic avansat, terapie targetată și strategii preventive direcționate pentru grupurile cu risc (de exemplu, gravide și pacienți cu imunosupresie). Aceasta reflectă o tendință mai largă în imunologie: înțelegerea detaliilor moleculare ale răspunsurilor imune permite dezvoltarea intervențiilor mai precise, care maximizează protecția și minimizează efectele adverse.
În final, această linie de cercetare ilustrează un principiu mai larg al biologiei gazdă-patogen: uneori, cel mai eficient mod de a opri un intrus nu este să încerci să-l expulzezi activ, ci să nu-i mai oferi niciun teren pe care să se stabilească. Caspaza-8, în acest caz, este un comutator molecular care face exact această negare de spațiu replicativ pentru parazit.
Sursa: sciencealert

Lasă un Comentariu