10 Minute
Cercetători de la MIT și Stanford au dezvoltat o abordare nouă de imunoterapie care dezactivează o „frână” moleculară bazată pe zaharuri de pe celulele canceroase, permițând sistemului imunitar să detecteze și să distrugă tumori care anterior ocoleau supravegherea imună. Strategia folosește proteine hibride proiectate, numite AbLecs — anticorpi legați de lectine — pentru a bloca semnalele mediate de glicani care suprimă activitatea imunitară.
De ce contează glicanii: semnalele ascunse de zahăr de pe celulele canceroase
Glicanii sunt structuri complexe de zaharuri care acoperă aproape fiecare celulă din organism, alcătuind o „haină” glicozilată la suprafața celulelor. Procesul de transformare tumorală alterează acest strat glicanic: celulele tumorale frecvent prezintă glicani neobișnuiți, bogați în acid sialic. Glicanii care poartă acid sialic se leagă de receptori de tip lectină de pe celulele imune, cunoscuți sub numele de Siglec, și activează o cale imunorepresivă ce funcționează ca o frână asupra răspunsurilor anti-tumorale.
Inhibitorii de checkpoint actuali — medicamente care blochează PD-1 sau PD-L1 — eliberează o clasă de frâne și au produs remisiuni dramatice și durabile la unii pacienți. Totuși, numeroase tumori rămân rezistente la aceste terapii. Axul Siglec–acid sialic reprezintă un checkpoint alternativ: atunci când Siglec-urile se leagă de acizii sialici de pe celulele canceroase, macrofagele, celulele NK (natural killer) și alți efectori imuni sunt mai puțin predispuși să atace. În termeni de imunoterapie, aceasta este o strategie de evaziune a imunității mediată de glicani, care devine din ce în ce mai recunoscută ca țintă terapeutică pentru oncologia de precizie.
Cum funcționează AbLecs: deturnarea lectinelor cu ajutorul anticorpilor
Inovația centrală dezvoltată de echipele de la MIT și Stanford este o proteină modulară denumită AbLec. Fiecare AbLec fusează un domeniu de tip lectină, capabil să se lege de glicanii care conțin acid sialic, cu un braț de anticorp care recunoaște un antigen tumoral specific. Anticorpul livrează și concentrează domeniul lectinic la suprafața celulei tumorale, unde acesta concurează cu Siglec-urile celulelor imune pentru legarea acidului sialic.
De la legare slabă la blocaj eficient
Domeniile lectinice, luate separat, tind să se lege slab și nu se acumulează eficient pe tumori. În schimb, anticorpii au afinitate ridicată pentru antigenele tumorale și se pot localiza la celulele canceroase în număr mare. Legarea unei lectine de un anticorp combină punctele forte ale ambelor componente: livrare țintită plus blocarea locală a glicanelor. Rezultatul este un decoy concentrat la nivel local care împiedică angajarea Siglec-urilor imunosupresoare și eliberează celulele imune pentru a ataca. Pe plan mecanic, AbLecs acționează atât prin competiție directă pentru epitope glicanice, cât și prin posibilitatea de a steric bloca accesul receptorilor imuni la liganzii lor.
Mai mult, designul modular permite inginerii fine: domeniul Fc al anticorpului poate fi optimizat pentru a spori funcții efectoare imunologice cum ar fi ADCC (citotoxicitatea mediată de anticorpi) sau ADCP (fagocitoza mediată de anticorpi), iar domeniul lectinic poate fi selectat pentru specificitate la motifuri de glicani relevante clinic. Astfel, AbLecs nu sunt doar blocante ale unui semnal, ci pot fi proiectate pentru a activa mecanisme efectoare specifice în microambientul tumoral.
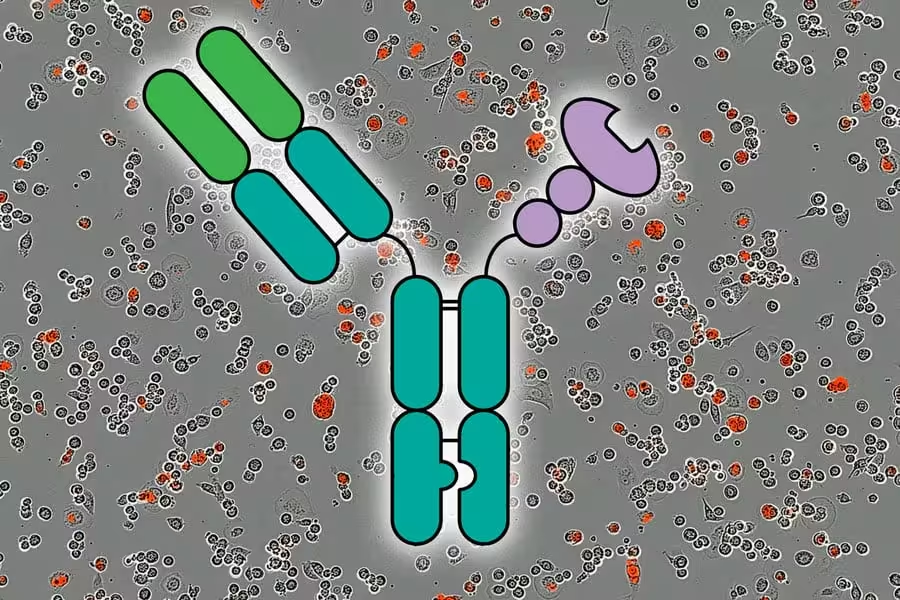
Cercetătorii au demonstrat că pot stimula un răspuns imun anti-tumoral puternic folosind molecule numite AbLecs, reprezentate aici în centru, care blochează un checkpoint imun. Fundalul arată fluorescență roșie, indicând celule canceroase ucise pe parcursul a 5 ore. Credit: Courtesy of the researchers; MIT News
Dovezi preclinice: de la culturi celulare la șoareci umanizați
Pentru a demonstra conceptul, echipa a construit un AbLec folosind trastuzumab (anticorpul anti-HER2) cu un domeniu lectinic derivat din Siglec-7 sau Siglec-9. În teste pe culturi celulare, acei AbLec-și au reprogramat celulele imune astfel încât să atace celulele tumorale HER2-pozitive. Într-un model de șoarece inginerizat să exprime Siglec-urile umane și receptorii umani pentru anticorpi, tratamentul cu AbLec a redus metastazele pulmonare în comparație cu trastuzumab administrat singur.
Aceste rezultate sunt semnificative deoarece arată că atât efectorii imuni innati (cum ar fi macrofagele și celulele NK), cât și răspunsurile adaptive pot fi eliberate prin blocarea checkpoint-urilor bazate pe glicani. În anumite configurații tumorale în care terapia cu anticorpi standard avea efect limitat, adăugarea componentei lectinice a redus încărcătura tumorală. Experimentele au inclus măsurători funcționale—fagocitoză crescută, activare de citokine pro-inflamatorii și semne de moarte celulară mediată imun—care susțin mecanismul propus.
Modelul preclinic a folosit multiple linii celulare și modele animale relevant humanizate pentru a evalua interacțiunile complexe între antigen, glicani și receptori Siglec umani. Rezultatele au fost consistente cu ipoteza că blocarea axei Siglec–sialic poate transforma un microambient tumoral „rece” într-unul „cald”, mai susceptibil la atacul imunitar. Cu toate acestea, autorii recunosc limitele modelelor animale și importanța translării în studii clinice umane.
Design modular: o platformă plug-and-play
Unul dintre cele mai promițătoare aspecte ale AbLecs este modularitatea. Brațul anticorpului poate fi înlocuit pentru a viza antigene tumorale diferite — de exemplu, rituximab (CD20) pentru cancerele cu celule B sau cetuximab (EGFR) pentru alte tumori solide. În mod similar, domeniul lectinic poate fi schimbat pentru a viza glicani distincti sau membri diferiți ai familiei de receptori lectinici. Această arhitectură plug-and-play deschide posibilități pentru personalizarea în funcție de tipul specific de cancer, precum și pentru strategii combinate cu alte terapii oncologice.
Deoarece multe tipuri tumorale se bazează pe suprimarea imunității mediată de glicani, AbLecs ar putea completa inhibitorii de checkpoint existenți sau ar putea servi pacienților care nu răspund la blocada PD-1/PD-L1. De asemenea, sunt adaptabile pentru a viza motive glicanice imunorepresive multiple care apar în cancer diferit, oferind o strategie versatilă pentru a contracara heterogenitatea tumorală. În practică, platforma permite dezvoltarea de panouri de AbLecs ce pot fi combinate în funcție de profilul glicanic și antigenic al tumorii.
Provocări și pași următori
Există provocări importante înainte ca AbLecs să ajungă la pacienți. Glicanii asociați tumorii pot fi exprimați, la niveluri mai scăzute, și pe țesuturi sănătoase — ceea ce ridică întrebări privind efectele off-target și siguranța. Sistemul imunitar poate recunoaște noile construcții proteice ca fiind străine, astfel încât imunogenicitatea și strategiile de dozare trebuie testate riguros. Producția la scară largă a unor proteine hibride complexe este un alt obstacol real în dezvoltarea clinică, incluzând stabilitate, purificare și costuri manufacturiere.
Relevanța clinică necesită studii umane randomizate pentru a evalua eficacitatea, tolerabilitatea și pentru a confirma dacă AbLecs extind, în mod real, populația de pacienți care beneficiază de imunoterapie. Modelele preclinice justifică trecerea la studii clinice timpurii, dar doar studii bine concepute vor determina valoarea clinică. În plus, va fi esențială definirea biomarkerilor predictivi (de exemplu, încărcătura de glicani sialica, expresia Siglec, profilul Fc-receptorilor pacientului) pentru selecția pacienților și pentru optimizarea regimurilor de combinație.
Din perspectivă regulatoare, companiile și cercetătorii vor trebui să definească criterii clare de siguranță, parametri de farmacodinamică și farmacocinetică, precum și planuri pentru monitorizarea reacțiilor imune adverse. Strategii de atenuare pot include ingineria domeniului Fc pentru a controla activarea efectorilor sau utilizarea de antigene tumorale foarte specifice pentru a reduce retenția pe țesuturi normale.
Expertiză și perspectivă clinică
„Atingerea peisajului glicanic este o modalitate elegantă de a extinde aria imunoterapiei,” spune Dr. Elena Morales, imunooncolog care nu a fost implicată în studiu. „AbLecs rezolvă inteligent o problemă de livrare — transformă legătorii glicani slabi în blocante potențe și localizate la tumoră. Dacă siguranța și specificitatea se confirmă în studii clinice, această abordare ar putea deveni un complement important pentru inhibitorii PD-1/PD-L1.”
Opinia experților subliniază două aspecte: importanța validării clinice și potențialul de integrare într-un portofoliu terapeutic combinatoriu. Specialiștii în dezvoltare farmacologică subliniază că optimizarea Fc și selecția domeniilor lectinice sunt cruciale pentru a maximiza eficiența și a minimiza riscurile prin reducerea retenției pe țesuturile normale și scăderea imunogenicității.
Implicații pentru pacienți și terapii
Pentru pacienți, tehnologia AbLec promite două avantaje majore: în primul rând, capacitatea de a contracara un mecanism de evaziune imună anterior netintit; în al doilea rând, flexibilitatea de a fi adaptată la antigene tumorale și ținte glicanice diferite. În principiu, asta înseamnă că o fractiune mai largă de cancere ar putea deveni receptivă la imunoterapie, inclusiv tumori care au fost refractare la inhibitorii convenționali de checkpoint.
În termeni practici, clinicienii și cercetătorii vor trebui să definească biomarkeri care să prevadă care tumori sunt conduse de interacțiuni acid sialic–Siglec. Selecția pacienților, regimurile combinate (de exemplu, AbLecs plus inhibitori PD-1, vaccinuri tumorale sau chimioterapie) și monitorizarea intensă a siguranței vor dicta modul în care AbLecs vor fi folosite alături de tratamentele existente. De asemenea, vor fi necesare studii de cost-eficacitate pentru a înțelege impactul economic al unei tehnologii complexe față de terapiile standard.
Privind înainte
Strategia AbLec ilustrează o tendință mai largă în imunologia cancerului: direcționarea semnalelor biochimice din microambientul tumoral, nu doar a punctelor de control ale celulelor imune. Prin conversia unor decoy-uri moleculare în terapii țintite, oamenii de știință urmăresc să expună cancerul sistemului imunitar în moduri noi și complementare. Următoarele capitole ale acestei abordări vor fi scrise în studiile clinice timpurii, unde eficacitatea, siguranța și impactul în lumea reală vor fi evaluate.
Pe măsură ce cercetarea avansează, este probabil ca tehnologiile derivate — cum ar fi AbLecs cu domenii lectinice multiple, panouri de anticorpi pentru heterogenitatea tumorală sau combinații cu terapii celulare — să fie testate. Relevanța clinică va depinde de capacitatea de a identifica pacienții corecți, de a optimiza manufactura și de a demonstra beneficii clinice clare față de standardul de îngrijire. Totodată, monitorizarea atentă a efectelor off-target și a răspunsurilor imune adverse rămâne o prioritate.
În ansamblu, AbLecs reprezintă o abordare inovatoare și flexibilă, cu potențialul de a extinde frontierele imunoterapiei oncologice prin țintirea unei clase de semnale moleculare — glicanii sialicați — care până acum au fost relativ neexplorate din punct de vedere terapeutic. Urmează ca studiile clinice să confirme dacă această promisiune se traduce în beneficii sigure și semnificative pentru pacienți.
Sursa: scitechdaily


Lasă un Comentariu