8 Minute
Imaginați-vă o sală de așteptare în care grupa sanguină nu mai decide cine primește rapid un rinichi. Aceasta este promisiunea din spatele unui progres recent în laborator: cercetătorii au transformat un rinichi de tip A într-un organ descris ca fiind convertit enzimatic în tip O —, adică un rinichi căruia i s-au îndepărtat markerii zaharoși care îl făceau recunoscut ca tip A. Scopul este simplu, dar uriaș: extinderea compatibilității astfel încât un număr mai mare de pacienți să poată primi transplanturi mai devreme.
Cum funcționează convertirea și ce au testat oamenii de știință
Grupele sanguine se bazează pe molecule zaharoase minuscule, cunoscute sub numele de antigene, care „împodobesc” suprafața celulelor și a țesuturilor. Sistemul imunitar folosește anticorpi pentru a citi acele etichete moleculare. Dacă întâlnește o etichetă pe care o recunoaște ca străină, poate urma un răspuns imun care conduce la respingere. Echipa a folosit enzime — „foarfeci” moleculare proiectate pentru a tăia reziduuri zaharoase specifice — pentru a rade părțile antigene ale lanțurilor de tip A. Odată eliminati acești zahari, suprafața organului devine în practică lipsită de antigenele ABO, având un profil asemănător tipului O.
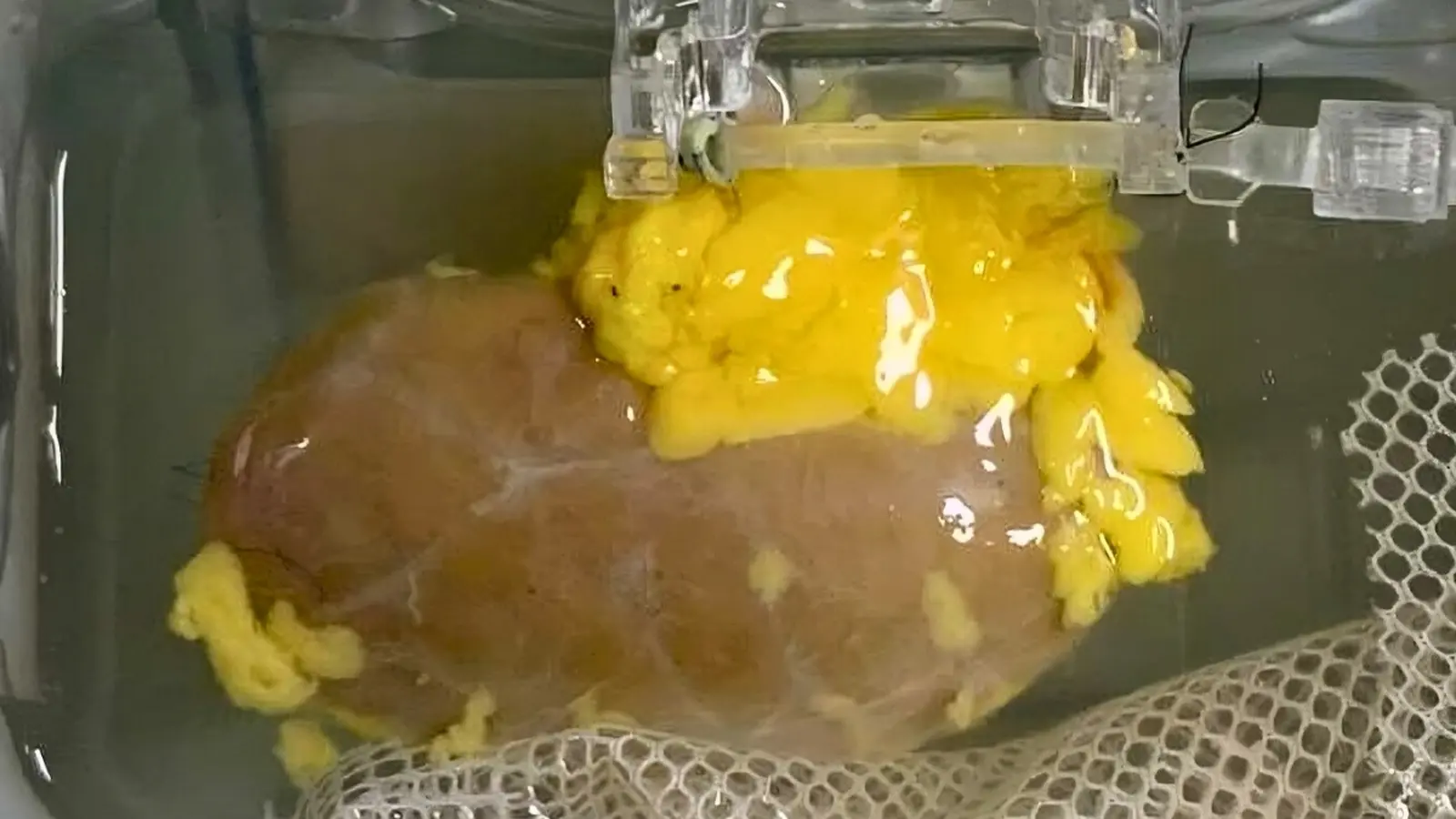
Acesta nu este un exercițiu teoretic limitat la fiola de laborator. Un grup colaborativ din Canada și China a pregătit un rinichi convertit enzimatic în tip O (ECO) și l-a transplantat în corpul unui donator aflat în moarte cerebrală, care fusese autorizat pentru cercetare. Organul a funcționat timp de câteva zile, demonstrând că abordarea poate produce un organ viabil în mediul fiziologic. Nu a fost perfect: începând cu ziua a treia, urme ale markerilor originali de tip A au început să reapară pe suprafața organului, iar un răspuns imun a devenit detectabil. Totuși, reacția a fost mai blândă decât se anticipase, ceea ce sugerează că metoda tinde să „îndeplineze” sistemul imunitar spre toleranță, mai degrabă decât să inducă o respingere puternică imediată.
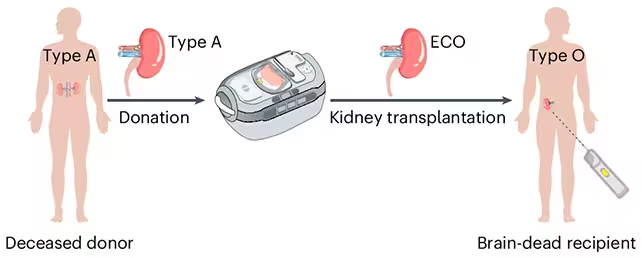
Cercetătorii au obținut un rinichi convertit enzimatic tip O (ECO), pregătit pentru transplant.
De ce contează această realizare și ce urmează
Pacienții de tip O se confruntă cu cele mai lungi liste de așteptare pentru că rinichii de tip O sunt căutați de toți: O este tipul universal donator pentru globulele roșii, iar în practică rinichii de tip O sunt considerați compatibili cu celelalte grupe sanguine. Această disproporție are consecințe mortale. Numai în Statele Unite, aproximativ 11 persoane mor în fiecare zi în așteptarea unui transplant de rinichi; mulți dintre aceștia sunt în așteptare pentru organe de tip O.
Există soluții alternative în prezent. Medicii pot desfășura proceduri de desensibilizare a receptorului sau pot elimina anticorpi specifici înainte de transplant (plasmafereză, imunoadsorbție), dar aceste protocoale sunt complexe, costisitoare și riscante — și, de regulă, necesită un donator viu și timp pentru pregătirea pacientului. Convertirea enzimatică a rinichilor de la donatori decedați ar putea schimba aceste calcule prin extinderea rapidă a bazei de organe utilizabile, fără necesitatea unei precondiționări îndelungate a receptorului. Acest lucru ar putea reduce semnificativ timpii de așteptare, îmbunătăți echitatea în alocarea organelor și salva vieți.
Rămân însă numeroase provocări științifice și clinice. Re-exprimarea antigenelor după câteva zile sugerează fie o îndepărtare incompletă a zaharurilor antigene, fie un turnover natural la nivelul glicoproteinelor de la suprafață, fie o regenerare stimulată de sistemul imunitar a acelor oligozaharide. Durabilitatea pe termen lung a conversiei, posibilele efecte secundare ale enzimelor folosite, și riscul unor modificări tisulare neintenționate (de exemplu, modificări ale glicocalixului care afectează funcția tubulilor renali sau interacțiunile celulă-matrix) necesită studii sistematice suplimentare. Obstacolele de reglementare și testele clinice la scară mai mare sunt pași obligatorii înainte ca spitalele să poată adopta această tehnică în practică.
.avif)
Acest demers se înscrie alături de alte strategii menite să atenueze penuria de organe: xenotransplantul folosind rinichi de porc modificați genetic, anticorpi proiectați pentru a atenua respingerea, regimuri îmbunătățite de imunosupresie și platforme de bioinginerie tisulară pentru organe artificiale. Împreună, ele reprezintă un atac multiprong asupra aceleiași probleme — prea mulți pacienți, prea puține organe.
„Este un moment rar în care decenii de glicobiologie moleculară se intersectează cu nevoia clinică de la patul bolnavului”, a observat unul dintre investigatori, subliniind cum chimia enzimatică de bază este în sfârșit testată într-un model uman. Rezultatele sunt preliminare, dar indică o direcție în care compatibilitatea este inginerizată activ, în loc să fie doar așteptată pasiv.
Dacă convertirea enzimatică poate fi făcută durabilă și sigură la scară, impactul asupra listelor de așteptare ar putea fi dramatic: mai mulți rinichi utilizabili, timpi de așteptare mai scurți și mai puține decese prevenibile. Această lucrare reamintește că soluțiile la crize clinice pot proveni din editări moleculare mici și precise — o tăietură enzimatică aici, o viață salvată acolo.
Pentru pacienți și clinicieni deopotrivă, următorii ani vor fi esențiali: studii clinice mai ample, evaluări riguroase de siguranță și monitorizare atentă pentru a determina dacă acest „truc” molecular se traduce într-un beneficiu clinic durabil. Sunt necesare protocoale standardizate pentru dozajul enzimelor, timpii de expunere, metodele de perfuzie ex vivo și criteriile de selecție a organelor care să asigure reproducibilitate și siguranță.
Pe plan tehnic, optimizarea lagerului enzimatic implică alegerea unor glichenaze foarte specifice (exoglicanaze sau endoglicanaze) care să taie legăturile corespunzătoare fără a afecta structura proteică de bază a glicoproteinelor esențiale funcției renale. De asemenea, condițiile de tratament — pH, temperatură, timp de expunere și mediu de perfuzie ex vivo — trebuie adaptate pentru a minimiza stresul izoenzimic asupra celulelor endoteliale și tubulare. Tehnici adiacente, precum perfuzia normotermică ex vivo cu soluții nutritive și agenți antiinflamatori, pot spori eficiența conversiei și pot susține viabilitatea organului până la momentul transplantului.
Din perspectiva imunologică, abordarea trimite semnale importante: reducerea antigenelor ABO poate scădea imediat reacțiile mediate de anticorpi naturali (anti-A și anti-B), dar nu elimină alte tipuri de incompatibilități, cum ar fi cele mediate de antigeni HLA sau de alloanticorpi preexistente la receptor. Astfel, convertirea enzimatică ar trebui văzută ca o măsură complementară la pachetul de strategie pentru transplant, nu ca o soluție unică. Integrarea sa cu testarea HLA, cu managementul anticorpilor și cu protocoalele de imunosupresie va fi esențială pentru succesul clinic pe termen lung.
În termeni de cercetare și dezvoltare, următoarele etape logice includ:
- Reproducerea studiului în mai multe modele umane ex vivo și animale pentru a evalua consistența conversiei și variabilitatea între donatori.
- Optimizarea panopliei enzimatice pentru eficiență sporită și minimizarea reacțiilor off-target.
- Studii de farmacocinetică și farmacodinamică pentru a înțelege cum sunt eliminate, inactive sau neutralizate enzimele după perfuzia organului.
- Programe de monitorizare pe termen lung pentru a urmări re-exprimarea antigenelor, funcția renală și riscul de complicații infecțioase sau trombotice.
Reglementatorii vor cere dovezi robuste privind siguranța și eficacitatea, inclusiv date despre potențialele efecte toxice ale reziduurilor enzimatice, riscul de modificări permanente ale țesutului și capacitatea de a reproduce rezultatele la scară industrială. În plus, implementarea clinică trebuie să țină cont de costuri, logistică (de ex., unități de perfuzie ex vivo în centrele de transplant) și de formarea personalului.
În final, acest experiment rămâne un proof-of-concept plin de speranță — un exemplu despre cum intervențiile moleculare precise pot remodela protocoalele clinice tradiționale. Fiecare progres în această direcție trebuie evaluat critic, dar și privit ca o oportunitate de a reimagina modul în care alocăm un resursă atât de limitată precum organul disponibil pentru transplant.
Până când datele clinice extinse și aprobările regulatorii vor confirma siguranța și eficacitatea, convertirea enzimatică a rinichilor va rămâne o abordare promițătoare, dar experimentală. Totuși, perspectiva unui sistem în care compatibilitatea este creată activ — prin biotehnologie, nu doar prin norocul unui grup sanguin potrivit — oferă o imagine optimistă pentru viitorul transplantului: liste de așteptare mai scurte, distribuție mai echitabilă a organelor și, în cele din urmă, mai multe vieți salvate.
Până atunci, experimentul stă ca o dovadă de principiu plină de speranță — câte o tăietură enzimatică la un moment dat.
Sursa: sciencealert

Lasă un Comentariu