11 Minute
După mai mult de un deceniu de muncă în laborator, cercetătorii raportează un avans important în direcția obținerii de rinichi care ar putea fi acceptați de primitori indiferent de grupa sanguină. O echipă internațională a reușit să convertească rinichi donatori într-o formă fără antigeni care — cel puțin temporar — s‑a comportat ca un organ de tip O când a fost transplantat într‑un model uman, un pas care ar putea contribui la reducerea listelor lungi de așteptare pentru transplant și la salvarea de vieți.

Rinichiul pregătit în laborator
Transformarea barierelor legate de grupa sanguină într‑o problemă tehnică
Compatibilitatea grupelor sanguine reprezintă una dintre cele mai mari piedici practice în transplantul renal. Sistemul ABO impune o constrângere strictă asupra persoanelor care pot primi un anumit organ: pacienții de tip O trebuie, de regulă, să aștepte un donator de tip O, iar rinichii de tip O sunt deosebit de solicitați deoarece pot funcționa la primitori din alte grupe sanguine. Această dinamică creează inegalități în accesul la transplant și agravează penuria de organe disponibile pentru pacienții cei mai vulnerabili.
Pentru a evita această limitare, oamenii de știință au adaptat enzime capabile să elimine selectiv moleculele zaharoase — denumite antigene — de pe suprafața celulelor sanguine și a țesuturilor donatoare, care semnalează sistemului imunitar că „acesta este străin”. Echipa de cercetare a utilizat astfel de enzime pentru a îndepărta markerii caracteristici sângelui de tip A de pe un rinichi donat, convertindu‑l practic într‑un organ de tip O convertit enzimatic (enzyme‑converted type‑O, ECO).
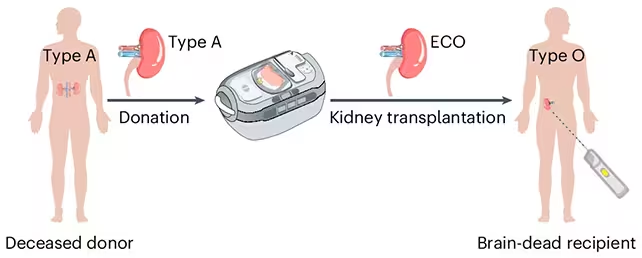
O echipă de cercetători a produs un rinichi tip‑O convertit enzimatic (ECO) pregătit pentru transplant. (Zeng et al., Nat. Biomed. Eng., 2025)
Biochimistul Stephen Withers de la Universitatea British Columbia, citat în raportul original, compară enzimele cu o pereche de foarfece moleculare: ele taie lanțurile de zaharuri antigenice care definesc tipul A, dezvăluind echivalentul chimic neutru al unei suprafețe de tip O. „Odată ce acest lucru s‑a întâmplat, sistemul imunitar nu mai percepe organul ca pe unul străin”, explică el, subliniind că acesta este primul test al metodei într‑un model uman. Această analogie ajută la înțelegerea mecanismului: enzimele nu modifică ADN‑ul organului, ci facilitează eliminarea temporară a etichetelor moleculare care declanșează răspunsul imun.
Din punct de vedere tehnic, conceptul se bazează pe cunoașterea detaliată a structurii antigene ABH și a enzimologiei care poate scinda legăturile glico‑conjugate. Eforturile anterioare au vizat fie modificări genetice, fie intervenții imunologice în receptor; aici, intervenția ex vivo (în afara corpului) asupra rinichiului oferă un avantaj logistic și de control: tratamentul poate fi aplicat direct pe organ, în condiții standardizate, înainte de implantare, fără expunerea imediată a pacientului la tratamente imunodepresive suplimentare.
Ce a demonstrat transplantul experimental — și ce nu
Rinichiul convertit a fost implantat într‑un donator aflat în moarte cerebrală care își dăduse consimțământul, prin familie, pentru utilizare în cercetare; organul a funcționat câteva zile în acel recipient. Acea perioadă de funcționare a furnizat oamenilor de știință date valoroase din condiții reale despre modul în care răspunde sistemul imunitar atunci când markerii ABO ai unui organ sunt eliminați chimic.
Funcționalitatea pe termen scurt a permis monitorizarea parametrilor renali esențiali — debitul urinar, clearance‑ul creatininei, tensiunea arterială medie asociată funcției renale și markeri inflamatori sistemici — oferind dovezi preliminare că tratamentul enzimatic nu compromisează imediat funcția filtrativă a organului. Aceste date clinice și paraclinice sunt cruciale pentru a înțelege profilul de siguranță și eficiență în contextul transplantului.
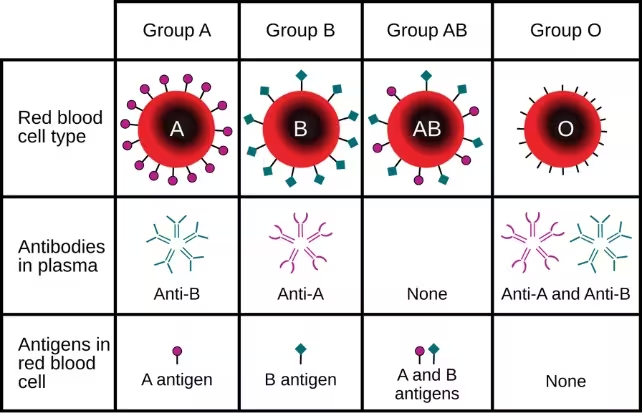
Cu toate acestea, conversia nu a fost permanentă. În a treia zi după transplant, markerii de tip A au început să reapară pe țesuturile rinichiului, provocând un răspuns imun. În mod critic, reacția a fost mai puțin severă decât s‑ar fi anticipat în mod normal pentru un transplant incompatibil, iar semnele arătau că biologia gazdei se îndrepta către o toleranță parțială, mai degrabă decât către o respingere acută completă. Totuși, reexprimarea scoate în evidență o provocare centrală: cum poate fi făcută eliminarea antigenică suficient de durabilă pentru a fi folosită în mod rutinier la pacienți vii.
Reapariția antigenelor poate avea cauze multiple: sinteza și reexpunerea moleculelor de la celulele endoteliale reziduale, transferul de antigene de la plasmă sau reinserția enzimelor inactivate. În plus, procesele de re‑glicozilare intrinsece celulelor donatoare pot reactiva rapid epitopii ABH. Soluționarea acestor mecanisme biologice necesită fie îmbunătățirea persistenței enzimelor aplicate ex vivo, fie combinarea cu strategii care reduc capacitatea țesuturilor de a reface rapid antigenele.
Context: de ce ar putea aceasta schimba logistica transplantului renal
Penumia de rinichi este evidentă. Doar în Statele Unite, aproximativ 11 persoane mor în fiecare zi așteptând un transplant renal, iar multe dintre aceste decese survin în rândul celor care au nevoie de organe de tip O. Strategiile clinice actuale pentru depășirea incompatibilității de tip sanguin — așa‑numitele protocoale de desensibilizare — pot funcționa, dar sunt consumatoare de timp, riscante și costisitoare. Aceste protocoale includ plasmafereză repetată, administrare de imunoglobuline intravenoase (IVIG) și tratamente cu anticorpi monoclonali, și de obicei necesită ca recipentul să fie identificat din timp, limitând aplicabilitatea lor în cazul donatorilor decedați.
Dacă ar exista o metodă fiabilă de a converti rinichii donatori într‑o formă „universală”, bazinele de organe utilizabile s‑ar putea extinde dramatic, timpii de așteptare s‑ar scurta, iar mortalitatea listelor de transplant s‑ar reduce. Logistica ar deveni mai simplă: în loc de potriviri stricte ale tipurilor ABO sau de regimuri lungi de desensibilizare, clinicile ar putea trata organul ex vivo și ar putea proceda la transplant mai rapid, reducând timpul în care un organ rămâne neutilizat și sporind eficiența rețelelor regionale de transfer de organe.
Impactul asupra sistemelor de sănătate ar fi semnificativ: costuri reduse pe termen lung datorită scăderii zilelor de dializă, diminuarea cheltuielilor cu protocoalele de desensibilizare și optimizarea utilizării unităților de terapie intensivă pentru cazurile perioperatorii. În plus, pacienții ar beneficia de reducerea perioadelor de așteptare și de o calitate a vieții mai bună, cu mai puține complicații asociate dializei cronice.
Obstacole științifice și pași următori
Rămân numeroase probleme tehnice și clinice înainte ca această abordare să poată fi oferită pacienților vii. Întrebările cheie includ cum să se prevină reaparitia antigenelor, cum să se scaleze tratamentele enzimatice pentru numeroase organe, și cum să se asigure că conversia nu introduce alte vulnerabilități — cum ar fi o susceptibilitate crescută la infecții sau activare imună dăunătoare. Orice intervenție ex vivo trebuie caracterizată riguros din punct de vedere al stabilității, toxicității, și riscului de interferență cu integritatea structurală a organului.
Cercetătorii iau în considerare strategii complementare: combinarea eliminării antigenice cu imunosupresie țintită sau imunomodulare, îmbunătățirea potenței și retenției enzimelor (de exemplu, prin încapsulare sau modificări chimice care le cresc durata de viață la nivelul vaselor), sau combinarea conversiei cu alte inovații precum anticorpi injinerizați sau xenotransplantul (rinichi de porc modificați genetic). Studiile longitudinale în modele animale și lucrări adiționale în modele umane vor fi necesare pentru a cartografia siguranța și durabilitatea înainte de a lansa studii clinice controlate pe pacienți vii.
Din perspectivă regulatoare, vor fi necesare protocoale robuste de control al calității pentru producerea enzimelor, standarde pentru procesele ex vivo și criterii clare de incluziune/excluziune pentru pacienți. Etica cercetării în transplant implică, de asemenea, transparență în privința riscurilor și beneficiilor, consimțământ informat și considerente privind utilizarea donatorilor în moarte cerebrală pentru teste experimentale.
Pe termen mediu, echipele multidisciplinare vor trebui să colaboreze pentru a răspunde: ce nivel de „demasking” antigenic este necesar pentru a permite transplantul sigur? Care combinații de terapii minimizează riscul reexpresiei? Există biomarkeri predictivi care pot ghida când un organ a fost convertit suficient și când e risc crescut de respingere? Răspunsurile la aceste întrebări vor determina traiectoria dezvoltării clinice.
Expert Insight
„Acesta este un progres măsurat, dar promițător,” spune Dr. Maya Patel, imunolog în transplanturi, care nu a fost implicată în studiu. „Demonstrarea funcției pe termen scurt într‑un model uman este un reper major. Următoarea sarcină este ingineria persistenței — asigurarea că profilul antigenic nu revine după zile sau săptămâni. Dacă oamenii de știință pot fixa conversia sau o pot asocia cu o reglare imună selectivă, impactul asupra listelor de așteptare ar putea fi enorm.”
Specialiștii urmăresc, de asemenea, căi paralele: algoritmi îmbunătățiți de potrivire a donatorilor, utilizarea mai largă a donatorilor vii, și organe animale modificate genetic. Împreună, aceste eforturi reflectă un atac în mai multe direcții asupra unei probleme globale — penuria de organe. Integrarea tehnologiilor enzimatic‑chimice cu progrese în biotehnologie și politici de sănătate poate oferi un cadru coerent pentru implementare clinică în viitor.
Ce înseamnă aceasta pentru pacienți și pentru sistemul de sănătate
Pentru pacienți, un rinichi universal sigur și fiabil ar însemna mai puține luni sau ani pe dializă și o mortalitate mai mică în timpul așteptării. Dializa cronică este asociată cu complicații cardiace, infecții și o calitate a vieții redusă; transplantul mai rapid poate reduce aceste consecințe. Pentru sistemele de sănătate, aceasta ar putea reduce costurile intense asociate cu dializa prelungită și procedurile complexe de desensibilizare, eliberând resurse medicale pentru alte nevoi critice.
Pentru cercetători, cazul prezintă o problemă clară de inginerie și imunitate: cum se poate realiza o corecție moleculară suficient de stabilă încât să schimbe practica clinică. Aceasta implică nu doar optimizarea enzimelor, ci și definirea strategiilor de monitorizare postoperatorie, managementul imunosupresiei și dezvoltarea unor protocoale standardizate ex vivo care pot fi reproduse în rețelele de transplant la scară largă.
Studiul a apărut în Nature Biomedical Engineering și reprezintă un exemplu concret al modului în care biochimia de bază se traduce spre îngrijirea pacienților. Așa cum a observat Withers în legătură cu progresul echipei, a vedea perspectivele din laborator apropiindu‑se de realitatea clinică este exact ceea ce motivează această muncă pe termen lung. Rămâne însă mult de făcut: studiile clinice extinse, reglementările adecvate și investițiile în infrastructura ex vivo vor fi esențiale pentru a transforma această promisiune într‑o practică sigură și echitabilă.
Sursa: sciencealert

Lasă un Comentariu