10 Minute
Cercetătorii au demonstrat că restabilirea echilibrului de activitate într-un grup foarte mic de neuroni din amigdala poate anula anxietatea și retragerea socială la șoareci. Acest rezultat indică un mecanism cerebral surprinzător de precis care ar putea ghida tratamente viitoare vizând circuitele pentru tulburările afective, inclusiv anxietatea și depresia.
Cercetătorii au descoperit că reechilibrarea activității într-un microcircuit minuscul din amigdala a fost suficientă pentru a inversa anxietatea și retragerea socială la șoareci. Descoperirea subliniază existența unui mecanism neuronal foarte specific care poate inspira terapii mentale mai țintite, bazate pe intervenții la nivel de circuit neuronal.
Cum a schimbat un singur circuit balanța emoțională
Studiul, condus de laboratorul de Fiziologie Sinaptică al lui Juan Lerma de la Institutul de Neuroștiințe (IN) — o colaborare între Consiliul Superior de Cercetări Științifice al Spaniei (CSIC) și Universitatea Miguel Hernández (UMH) din Elche — a trasat originea anxietății și a deficitului social către o populație discretă de neuroni din amigdala basolaterală. Prin restabilirea excitabilității normale în cadrul acelui circuit, echipa a inversat simptomele comportamentale la șoarecii care prezentau caracteristici comparabile cu aspecte ale anxietății, depresiei și retragerii sociale umane.
„Știam deja că amigdala joacă un rol central în frică și anxietate, dar această lucrare arată că activitatea dezechilibrată a unei populații specifice de celule este, în sine, suficientă pentru a genera comportamente patologice”, a declarat Lerma. Rezultatele, publicate în revista iScience, deschid o fereastră asupra modului în care mici deviații în semnalizarea neuronală pot remodela stările emoționale. Observațiile subliniază importanța microcircuitelelor amigdalei și relevanța lor pentru reglarea emoțiilor, plasticitatea sinaptică și conectivitatea excitator–inhibitor, elemente cheie în neuroștiința afectivă contemporană.
Inginerie genetică pentru a produce și apoi corecta dezechilibrul
Pentru a evidenția mecanismul, cercetătorii au folosit o linie de șoareci modificați genetic care supraexprimă gena Grik4. Această modificare duce la creșterea receptorilor kainat tip GluK4 pe anumite neuroni, făcându-i hiperexcitabili. Șoarecii care supraexprimă Grik4 prezintă anxietate marcată și interacțiune socială redusă — fenotipuri pe care echipa le-a caracterizat inițial încă din 2015. Modelul genetic oferă o platformă clară pentru a înțelege cum modificările moleculare ale semnalizării sinaptice se traduc în comportamente complexe, iar gene precum Grik4 devin ținte moleculare importante în cercetarea terapiilor țintite.
Folosind vectori virali și instrumente moleculare de ultimă generație, grupul a corectat selectiv expresia Grik4 în neuroni ai amigdalei basolaterale. Acea intervenție localizată a refăcut comunicarea normală cu un grup descendent de celule inhibitoare din amigdala centrolaterală — așa-numiții „neuroni cu activare regulată” — restabilind o relație echilibrată excitator–inhibitor în cadrul microcircuitului. Abordarea combină genetică de precizie și livrare virală pentru a manipula expresia receptorilor la nivel de subpopulații neuronale, o strategie esențială pentru cercetările care urmăresc dezvoltarea de terapii bazate pe circuit.
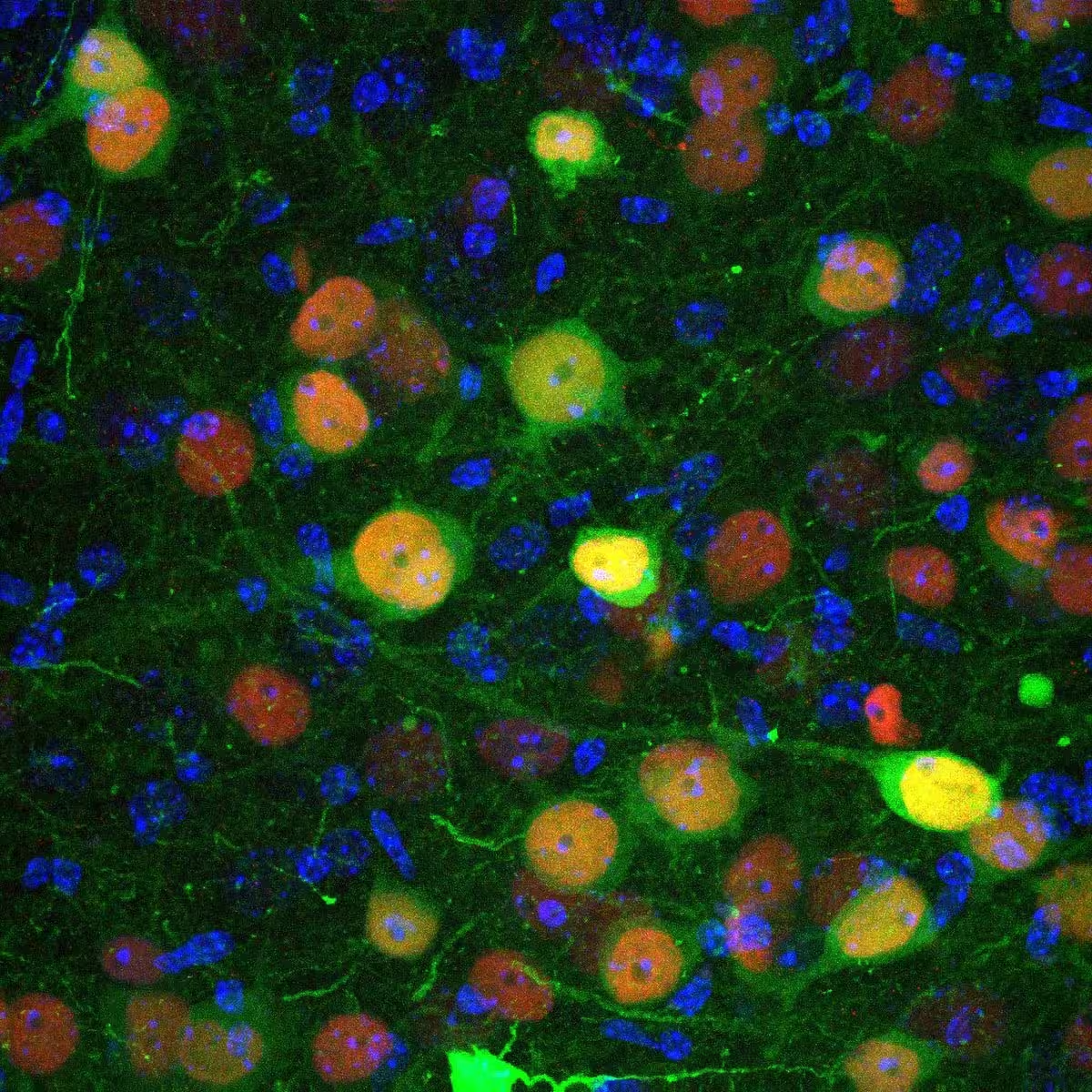
Imagine de microscopie confocală care arată celule din amigdala basolaterală infectate de un virus proiectat pentru a introduce proteina recombinază CRE (în roșu) și proteina fluorescentă GFP (în verde), permițând vizualizarea infecției.
Măsurarea circuitelor și a comportamentului în tandem
Echipa a combinat înregistrări electrofiziologice detaliate cu o baterie de teste comportamentale pentru a lega modificările sinaptice de comportamentul șoarecilor. Înregistrările neuronale au confirmat că corectarea expresiei Grik4 a normalizat ratele de ardere și răspunsurile sinaptice în calea amigdala basolaterală–centrolaterală. Din punct de vedere comportamental, șoarecii tratați au explorat spațiile deschise mai frecvent și au arătat un interes restabilit pentru conspecifi necunoscute — măsuri standard pentru reducerea anxietății și îmbunătățirea motivației sociale la rozătoare. Aceste măsurători combinate oferă o corelație robustă între modificările la nivel molecular, fenomenele electrice și comportament, întărind concluzia că intervențiile la nivel de microcircuit pot avea efecte funcționale semnificative.
Autorul principal, Álvaro García, a subliniat eleganța rezultatului: „Acea ajustare focalizată într-un singur microcircuit al amigdalei a fost suficientă pentru a inversa comportamentele asemănătoare anxietății și deficitului social — o recuperare remarcabil de specifică.” Țintirea genetică și repararea virală localizată le-au permis cercetătorilor să testeze causalitatea la rezoluție de circuit, în loc să se bazeze pe farmacologie largă, care afectează multiple regiuni și circuite. Această specificitate este esențială pentru dezvoltarea ulterioară a terapiilor cu impact minim asupra funcțiilor cognitive nedorite.
Nu este o soluție universală, dar oferă un plan promițător
Important, cercetătorii au testat aceeași abordare și pe șoareci wild-type ne-modificați genetic, care prezentau în mod natural anxietate mai pronunțată. Intervenția a redus, de asemenea, anxietatea acestor animale, sugerând că mecanismul ar putea generaliza dincolo de modelul genetic Grik4. „Acest lucru oferă încredere că principiul de circuit pe care l-am descoperit ar putea fi aplicabil mai larg în modul în care sunt reglate emoțiile”, a remarcat Lerma. Generalizarea către modele non-genetice indică faptul că principiile excitabilitate–inhibiție și conectivitatea sinaptică au relevanță pentru anxietate în contextul variabil al neurobiologiei naturale.
Totuși, unele deficite nu au fost remediate. Animalele tratate au păstrat deteriorări în memoria de recunoaștere a obiectelor, ceea ce indică faptul că simptomele cognitive implică regiuni suplimentare, precum hipocampul. Echipa a fost atentă să cadreze descoperirea ca o strategie țintită, nu ca un leac universal: corectarea unui microcircuit definit al amigdalei atenuează simptome afective specifice, dar nu anulează toate consecințele comportamentale ale alterării genetice de bază. Aceasta subliniază faptul că tulburările neuropsihiatrice complexe necesită abordări multimodale care pot combina intervenții la nivelul circuitelor cu terapii care vizează memoria sau procesele cognitive asociate.

Cercetători IN CSIC-UMH: Álvaro García, Juan Lerma, Ana Valero Paternain și María Isabel Aller.
De ce contează aceste rezultate pentru terapiile viitoare
Studiul scoate în evidență mai multe idei relevante pentru translație: în primul rând, că simptomele afective pot apărea din dezechilibre locale în excitabilitate și conectivitate sinaptică; în al doilea rând, că ținte moleculare precise (cum ar fi semnalizarea Grik4/GluK4) pot fi modulate într-o regiune cerebrală restrânsă pentru a produce beneficii comportamentale; și în al treilea rând, că intervențiile la nivel de circuit — fie genetice, farmaceutice sau neuromodulatorii — pot oferi alternative mai focalizate la medicamentele sistemice, cu potențial de reducere a efectelor secundare.
Privind înainte, terapiile inspirate de această lucrare ar putea încerca să reechilibreze dinamica excitatorie și inhibitorie în microcircuite definite ale amigdalei, folosind sisteme de livrare țintite sau neuromodulare rafinată, precum stimularea cerebrală profundă cu țintire de subnuclee sau tehnici emergente de livrare genetică selectivă. Totuși, traducerea descoperirilor din circuitele șoarecilor în tratamente umane sigure va necesita maparea tipurilor celulare comparabile în amigdala umană și dezvoltarea unor metode de livrare care să îndeplinească standardele de siguranță clinică. În plus, va fi esențială evaluarea pe termen lung a stabilității efectelor și a oricăror efecte secundare asupra memoriei sau funcțiilor cognitive.
Din perspectivă clinică, cercetările de acest tip pot contribui la dezvoltarea unor strategii de medicină de precizie în psihiatrie, în care intervențiile sunt adaptate la anomalii de circuit identificate la nivel individual. Identificarea biomarkerilor care semnalează disfuncții specifice ale microcircuitelor amigdalei — fie prin imagistică, biosemnale electrice sau profiluri moleculare — va facilita selecția pacienților care ar beneficia cel mai mult de intervenții țintite, maximizând eficiența terapeutică și minimizând riscurile.
Perspective și considerente tehnice
Din punct de vedere tehnic, studiul combină mai multe metode moderne: editare genetică pentru modelare (supraexprimare Grik4), vectori virali pentru livrare locală, electrofiziologie pentru măsurare de circuit, și teste comportamentale standardizate în neuroștiința comportamentală. Această abordare multidisciplinară este exemplară pentru cercetările care urmăresc să lege molecula la circuit și circuitul la comportament, oferind o cale robustă pentru demonstrarea cauzalității. În plus, folosirea atât a modelelor genetice, cât și a animalelor wild-type cu fenotipuri anxioase întărește relevanța generală a descoperirii.
Pe partea de biologie moleculară, receptorii kainat GluK4 mediatizați de Grik4 influențează curenți sinaptici excitațori și pot modifica atât proprietățile intrinseci ale neuronilor, cât și eficiența sinaptică. Reglarea fină a acestor receptori poate restabili homeostazia excitatorie–inhibitorie într-un microcircuit fragil, iar mecanismele de plasticitate dependente de acești receptori merită investigații suplimentare. În viitor, dezvoltarea de compuși farmacologici selectivi pentru GluK4 sau tehnologii de tip antisens/CRISPRi aplicate local ar putea oferi instrumente complementare terapiilor bazate pe livrare virală.
O provocare cheie pentru traducere este identificarea echivalentelor umane ale subtipurilor neuronale evidențiate în șoareci. Analize transcriptomice single-cell și atlasuri celulare ale amigdalei umane devin tot mai sofisticate și pot ajuta la cartografierea corespondențelor celulare. De asemenea, tehnici de neuromodulare non-invazivă sau minim invazivă, cum ar fi stimularea transcraniană sau implanturile cu țintire de înaltă rezoluție, ar putea fi adaptate pentru a modula echilibrul excitator–inhibitor în subregiuni specifice, dacă premisele anatomice și funcționale sunt similare la om.
Expertiză externă
Dr. Elena Ruiz, o neuroscientistă clinică care nu a fost implicată în studiu, a comentat: „Această cercetare este interesantă deoarece leagă genetica moleculară de fiziologia circuitelor și de comportament într-o lanț de cauzalitate. Nu promite o terapie imediată, dar arată că corecțiile foarte specifice la nivel de circuit pot avea efecte comportamentale majore — aceasta este claritatea mecanistică de care avem nevoie pentru a proiecta tratamentele de nouă generație.”
Comentariile experților externi subliniază că, deși rezultatele sunt promițătoare, translatarea în clinică va necesita eforturi suplimentare în cartografiere celulară, evaluări ale siguranței și strategii de livrare robuste. Totuși, studiul devine parte dintr-un corpus tot mai mare de dovezi care susțin ideea că tulburările afective pot fi abordate prin intervenții locale, specifice circuitului, deci oferă o direcție clară pentru viitoare cercetări și dezvoltare terapeutică.
În rezumat, restabilirea echilibrului excitator–inhibitor într-un microcircuit restrâns al amigdalei a arătat că este posibilă atenuarea semnificativă a unor manifestări de anxietate și a retragerii sociale la modele animale. Aceste rezultate susțin o viziune asupra viitoarelor strategii terapeutice bazate pe țintirea precisă a circuitelor neuronale implicate în reglarea emoțiilor, oferind în același timp o bază solidă pentru studii ulterioare care să exploreze siguranța, eficacitatea pe termen lung și aplicabilitatea la om.
Sursa: scitechdaily

Lasă un Comentariu