8 Minute
Noi cercetări din Coreea adaugă o întorsătură surprinzătoare în dialogul despre axul intestin‑creier: bacterii care în mod normal trăiesc în cavitatea orală pot coloniza intestinul, pot produce metaboliți care ajung la creier și pot accelera, potențial, boala Parkinson. Studiul cartografiază o rută biochimică de la microbii orali la afectarea neuronală și indică noi ținte pentru prevenție și terapie.
Un studiu recent sugerează că microbii proveniți din afara creierului pot influența stadiile incipiente ale bolilor neurodegenerative. Prin descoperirea unei căi biologice care leagă activitatea microbiană de lezarea neuronală, cercetarea contestă viziuni tradiționale despre modul în care se dezvoltă boala Parkinson și extinde înțelegerea axului intestin‑creier, microbiomului intestinal și implicațiilor pentru neurologie.
De la gură la intestin: cum ajunge un microb asociat cariilor la creier
Boala Parkinson este o afecțiune neurodegenerativă progresivă, caracterizată prin tremor, rigiditate, mișcări încetinite și, în esență, prin pierderea neuronilor care produc dopamină. Epidemiologia și studiile asupra microbiomului au sugerat de mult timp diferențe între microbiomul intestinal al persoanelor cu Parkinson și cel al persoanelor sănătoase; totuși, identificarea microbilor cauzali și a mecanismelor implicate a fost dificilă, din cauza complexității ecosistemului microbian și a variabilelor genetice și de mediu.
Studiul identifică Streptococcus mutans — o bacterie cu care majoritatea oamenilor asociază cariile dentare — ca unul dintre potențialii „vinovați”. Echipa de cercetare a detectat niveluri crescute de S. mutans în intestinul pacienților cu boala Parkinson. Odată stabilită în intestin, această bacterie produce o enzimă denumită urocanat reductază (UrdA) și un produs metabolic secundar numit imidazol propionat (ImP), ambii având implicații funcționale semnificative la nivel sistemic.
Constatarea că un microb oral poate coloniza intestinul și poate altera mediul metabolic local pune în prim‑plan importanța interacțiunilor dintre microbiota orală și cea intestinală. Acest fenomen subliniază ideea că igiena orală, sănătatea dentară și echilibrul microbian local pot avea efecte la distanță, inclusiv asupra sănătății neurodegenerative.
Un metabolit care traversează granițele: ImP și creierul
Imidazol propionat (ImP) este central în narațiunea studiului. Cercetătorii au detectat concentrații mai mari de ImP atât în intestin, cât și în sângele persoanelor cu Parkinson, ceea ce sugerează circulație sistemică a acestui metaboliți. Modelele animale au demonstrat că introducerea S. mutans în intestin sau ingineria genetică a E. coli pentru a exprima UrdA au crescut nivelurile de ImP în sânge și în țesutul cerebral, demonstrând capacitatea metabolitului de a traversa bariera periferică și de a ajunge la ținta neuronală.
Schimbările biochimice observate au venit însoțite de semne caracteristice patologiei Parkinson: pierdere de neuroni dopaminergici, creștere a inflamației neuronale, deteriorare a funcției motorii și o agregare mai puternică a alfa‑sinucleinei — proteina care formează aglomerările caracteristice în creierul pacienților cu Parkinson. Aceste observații sugerează o legătură funcțională între colonizarea microbiană orală, metaboliții microbieni și patologia neuronală asociată bolii Parkinson.
Cum afectează ImP neuronii?
Datele de laborator indică activarea complexului de semnalizare mTORC1 ca un pas cheie în mecanismul de lezare. Atunci când mTORC1 devine hiperactivat, procesele celulare responsabile de menținerea sănătății neuronale pot deveni disfuncționale, favorizând inflamația, stresul proteic și agregarea proteică. Activarea prelungită a mTORC1 poate afecta autofagia și homeostazia proteinelor, facilitând acumularea de proteine malpliate precum alfa‑sinucleina.
Un aspect important al lucrării constă în demonstrarea că inhibarea farmacologică a mTORC1 la șoareci a redus inflamația neuronală, pierderea neuronală și deficitele motorii, ceea ce leagă în mod direct prezența metabolitului microbian de o cale moleculară țintă. Această conexiune deschide posibilitatea dezvoltării de terapii care vizează fie producția microbiană de ImP, fie semnalizarea mTORC1 downstream, oferind strategii terapeutice pentru încetinirea progresiei neurodegenerative.
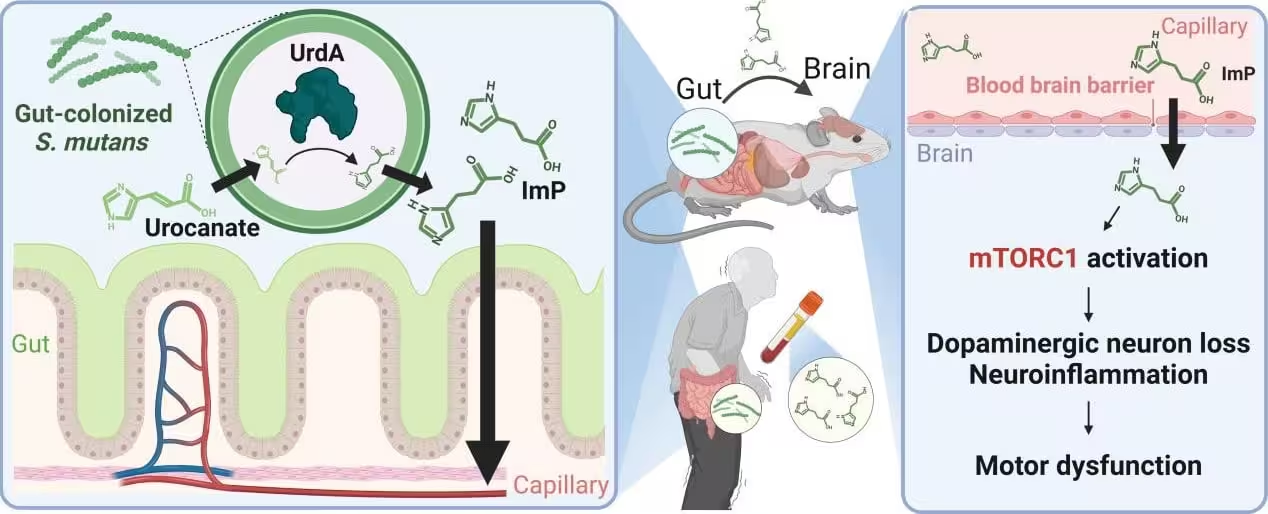
Diagramă a acumulării metabolitului în creier și inducerea bolii Parkinson după colonizarea intestinului cu bacterii orale.
Ce au făcut investigatorii și cine a condus cercetarea
Studiul reprezintă un efort colaborativ condus de profesoara Ara Koh și doctoranda Hyunji Park de la Departamentul de Științe ale Vieții al POSTECH, în colaborare cu cercetători de la Facultatea de Medicină a Universității Sungkyunkwan și de la Facultatea de Medicină a Universității Naționale din Seul. Echipa a combinat analiza microbiomului uman, măsurători metabolomice și modele controlate pe șoareci pentru a stabili legături funcționale între microbii orali și patologia cerebrală. Rezultatele complete au fost publicate în revista Nature Communications.
Metodologic, studiul implică secvențiere metagenomică pentru identificarea speciilor microbiene, cromatografie și spectrometrie de masă pentru cuantificarea metaboliților precum ImP, și experimente in vivo pentru a testa efectele colonizării microbiene și ale inhibiției farmacologice asupra parametrilor neuropatologici. Abordarea integrată — combinând date clinice umane și experimente mecanistice în modele animale — întărește robustețea concluziilor și relevanța translatională a descoperirilor.
„Studiul nostru oferă o înțelegere mecanică a modului în care microbii orali prezenți în intestin pot influența creierul și pot contribui la dezvoltarea bolii Parkinson”, a declarat profesoara Ara Koh. „Evidențiază potențialul țintirii microbiotei intestinale ca strategie terapeutică și deschide o nouă direcție pentru tratamentul Parkinson.”
Declarațiile autorilor subliniază faptul că aceasta reprezintă o contribuție importantă la literatura despre axul intestin‑creier, microbiomul oral și biomarkeri metabolici, dar și că sunt necesare studii clinice suplimentare pentru a traduce aceste descoperiri în intervenții sigure pentru oameni.
Implicații pentru prevenție și terapii viitoare
Implicațiile studiului sunt multiple. În primul rând, igiena orală de bază și sănătatea dentară ar putea fi mai importante decât s‑a apreciat anterior pentru sănătatea neurologică pe termen lung — un punct de sănătate publică subtil, dar aplicabil imediat: controlul cariilor, tratamentul bolilor parodontale și menținerea unei microbiote orale echilibrate pot deveni componente ale strategiilor preventive împotriva declinului neurologic.
În al doilea rând, identificarea ImP și a enzimei UrdA deschide rute concrete pentru intervenție terapeutică. Aceste strategii pot include: prevenirea colonizării intestinale de către S. mutans (prin măsuri de igienă, probiotice sau tratamente antimicrobiene locale), dezvoltarea de inhibitori ai UrdA pentru a bloca sinteza ImP, neutralizarea ImP circulant (de exemplu, prin molecule legătoare sau enzime degradative) sau modularea semnalizării mTORC1 pentru a proteja neuronii.
Fiecare dintre aceste abordări prezintă provocări: intervențiile antimicrobiene trebuie să respecte echilibrul microbiomului, inhibitorii enzimei trebuie să fie selectivi și siguri, iar modularea mTORC1 implică riscul perturbării unor funcții celulare esențiale. Cu toate acestea, combinarea strategiilor (de exemplu, măsuri de sănătate orală plus terapii mici molecule) ar putea reduce riscul și ar putea oferi beneficii sinergice.
Studiul subliniază, de asemenea, complexitatea axului intestin‑creier: microbii care își au originea într‑un compartiment al corpului (cavitatea orală) pot coloniza altul (intestinul), pot genera metaboliți care circulă sistemic și pot afecta organe îndepărtate, inclusiv creierul. Acest lucru implică necesitatea unor abordări interdisciplinare care integrează stomatologia, microbiologia, neurologia și farmacologia pentru a dezvolta strategii de prevenție și tratament.
Perspectivele experților
Dr. Lena Rothman, neuroimunolog la un centru medical major (comentând independent), a afirmat: „Această lucrare leagă elegant colonizarea microbiană, producția de metaboliți și o cale de semnalizare bine definită. Deși modelele pe șoareci nu reproduc perfect boala umană, identificarea ImP și a conexiunii cu mTORC1 oferă cercetătorilor ținte concrete — atât pentru biomarkeri, cât și pentru terapii.”
Comentariile experților adaugă context: validarea în cohortele umane mari, evaluarea predictivității nivelurilor de ImP pentru riscul sau progresia bolii și testarea intervențiilor în studii clinice sunt pașii următori esențiali. În același timp, datele sugerează integrarea mai strânsă a sănătății orale în practica clinică preventivă pentru neurologie, precum și explorarea microbiomului ca sursă de biomarkeri și ținte terapeutice.
Următoarele etape ale cercetării vor trebui să stabilească frecvența colonizării intestinale cu S. mutans în diferite populații, modul în care factorii dietetici, genetici și de mediu influențează producția de ImP și dacă nivelurile circulante de ImP pot servi ca biomarker precoce pentru boala Parkinson. De asemenea, este necesar să se evalueze siguranța și eficacitatea intervențiilor care țintesc UrdA sau mTORC1 la oameni.
În concluzie, lucrarea aduce o contribuție semnificativă la înțelegerea legăturilor dintre microbiomul oral, microbiomul intestinal și neurodegenerare, oferind direcții concrete pentru dezvoltarea de strategii preventive și terapeutice. Integrarea stomatologiei, microbiologiei și neurologiei devine astfel tot mai relevantă pentru abordarea complexă a bolilor neurodegenerative precum boala Parkinson.
Sursa: scitechdaily


Lasă un Comentariu