9 Minute
Un compus compact și ieftin a demonstrat efecte remarcabile într-un model experimental la șobolani pentru boala Alzheimer, inversând deficitele de memorie și reducând inflamația cerebrală. Descoperirea identifică un vinovat neașteptat: cuprul în exces prins în plăcile beta-amiloid. Cercetătorii care au realizat studiul afirmă că molecula este sigură în testele preclinice și ar putea avansa către studii la om — oferind un motiv prudent de speranță pentru o nouă direcție terapeutică.
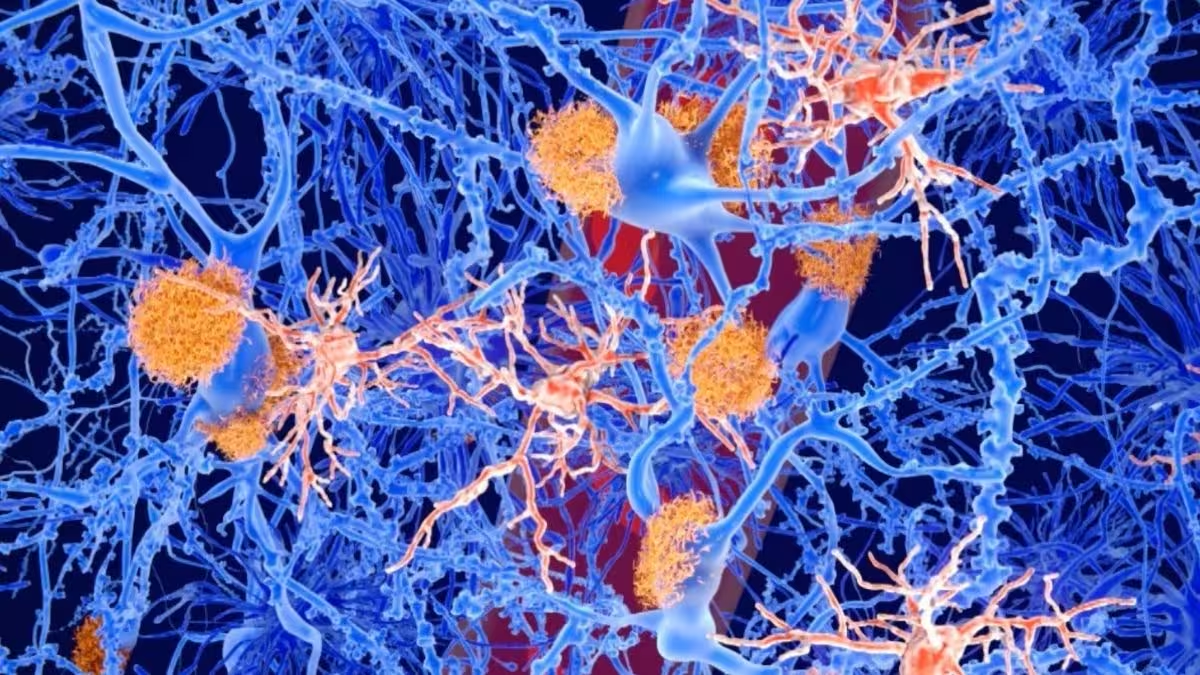
Impresie artistică a plăcilor amiloid (portocaliu) care se acumulează pe neuroni (albastru)
De ce contează cuprul în cercetarea Alzheimer
Boala Alzheimer este frecvent asociată cu agregate (plăci) de proteine beta-amiloid în creier. Rămâne controversat dacă aceste plăci sunt cauza directă a declinului cognitiv sau un efect secundar al altor procese patologice, însă ele constituie un obiectiv persistent pentru dezvoltarea de medicamente. Un fir biochimic care a atras atenția în ultimul deceniu este disfuncția ionilor metalici — în special a cuprului.
Cuprul este un metal esențial în cantități mici, necesar pentru funcționarea normală a creierului, inclusiv pentru activitatea unor enzime și pentru metabolismul energetic neuronal. Totuși, atunci când homeostazia cuprului se dezechilibrează — fie prin variații genetice, fie din cauza modificărilor enzimelor de transport al cuprului — metalul poate să se acumuleze în jurul depozitelor beta-amiloid. Excesul de cupru favorizează accelerarea agregării plăcilor și stimulează stresul oxidativ, un mecanism de deteriorare celulară asociat cu pierderea neuronală și declinul funcției cognitive.
În contextul tratamentelor pentru boala Alzheimer, reglarea metalelor cerebrale (metal homeostasis) devine o strategie terapeutică ce vizează mecanisme biochimice profunde: reducerea formării complexelor metal-proteină, prevenirea producției de specii reactive de oxigen și limitarea cascadelor inflamatorii care urmează.
De la simulări pe calculator la labirinturi pentru șobolani: cum au testat echipa compușii
Cercetătorii de la Universidade Federal do ABC (UFABC) din Brazilia au supus unei prese riguroase un set de nouă molecule candidate, concepute pentru a elimina sau chela cuprul în exces asociat cu beta-amiloid. Opt dintre candidate erau imine (molecule organice cu legătură dublă carbon-azot), iar una avea nucleu quinolinic. Simulările in silico inițiale au permis prioritizarea a trei candidați promițători — etichetați L09, L10 și L11 — care păreau capabili să traverseze bariera hemato-encefalică, o proprietate esențială pentru orice medicament menit să acționeze în creier.
Următorul pas a fost testarea toxicității pe celule. Neuronii de șoarece cultivați în laborator au fost expuși celor trei compuși selectați timp de 24 de ore. Unul dintre candidați, L11, a crescut semnificativ stresul oxidativ și a produs afectare celulară — ceea ce l-a descalificat efectiv. Cele două imine, L09 și L10, au arătat toxicitate redusă și au protejat lipidele și ADN-ul împotriva daunelor oxidative, indicând un profil de siguranță mai bun pentru testarea pe animale.
Echipa a continuat apoi cu un model bine stabilit la șobolani pentru Alzheimer. Patologia asemănătoare Alzheimer a fost indusă prin injectarea de streptozotocin, care perturbă semnalizarea insulinică cerebrală; această metodă favorizează acumularea de beta-amiloid și produce deficite cognitive caracteristice. Animalele tratate au fost evaluate prin măsurarea concentrațiilor de cupru, a markerilor inflamatori și ai stresului oxidativ, precum și prin performanța în teste de memorie spațială, cum sunt labirinturile și testele de orientare.
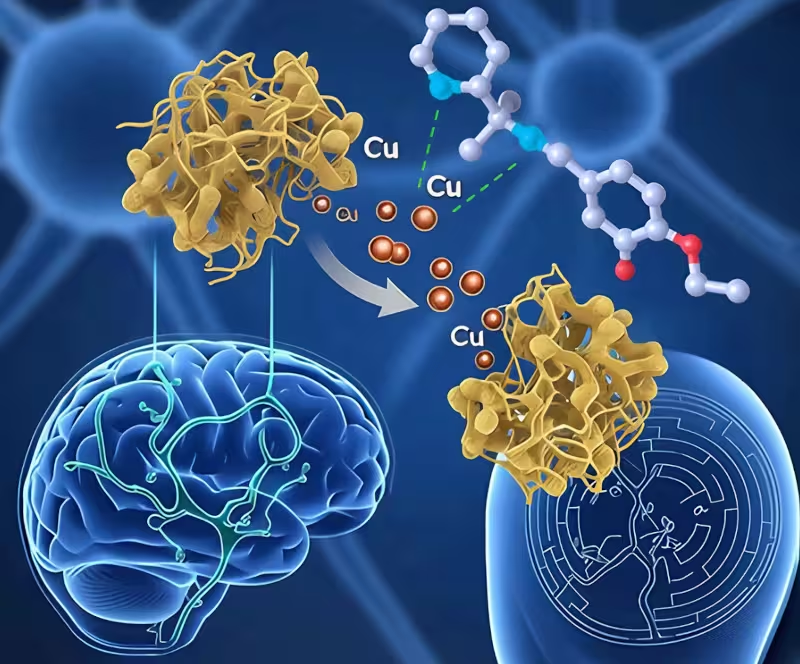
Noul compus poate elibera plăcile beta-amiloid de cuprul în exces
Descoperirea cheie: L10 restaurează echilibrul cuprului și memoria
Dintre cei trei candidați, compusul L10 s-a remarcat clar. Șobolanii tratați cu L10 au prezentat concentrații normalizate de cupru în hipocamp — regiunea cerebrală corelată strâns cu memoria pe termen scurt și lung. În plus, L10 a redus semnificativ markerii neuroinflamației și ai stresului oxidativ, iar animalele tratate au navigat mult mai bine în labirinturi comparativ cu grupul martor netratat.
Compusul L09 a demonstrat efecte mai slabe pe aceleași măsuri, iar L11 a rămas dăunător în testele pe celule. Pe baza acestor rezultate combinate, autorii au desemnat L10 drept candidatul cel mai potrivit pentru dezvoltare ulterioară și testare posibilă la om.
Coordonatoarea studiului, Giselle Cerchiaro (UFABC), a subliniat avantajele practice ale moleculei: are o structură chimică simplă și este ieftin de produs în comparație cu multe medicamente experimentale actuale. Această accesibilitate financiară poate fi esențială dacă compusul se dovedește eficient la pacienți, având în vedere că boala Alzheimer este o epidemie globală care afectează aproximativ 55 de milioane de persoane la nivel mondial și presupune costuri enorme pentru sistemele de sănătate.
Ce înseamnă aceasta pentru strategia de tratament în Alzheimer
Majoritatea terapiei aprobate în prezent pentru boala Alzheimer oferă ameliorare simptomatică, dar nu inversează în mod clar patologia de fond. O strategie bazată pe restabilirea echilibrului metalelor în creier — reducând agregarea plăcilor mediată de cupru și daunele prin stres oxidativ — reprezintă o abordare terapeutică alternativă, orientată către mecanisme biochimice fundamentale.
Importanța acestei abordări constă și în selectivitate: studiul sugerează că o astfel de terapie ar putea fi benefică pentru un subgrup de pacienți care prezintă disfuncție în homeostazia cuprului, mai degrabă decât pentru toți pacienții cu Alzheimer. Aceasta subliniază heterogenitatea biologică a bolii și necesitatea unor strategii personalizate, inclusiv utilizarea biomarkerilor pentru identificarea pacienților care ar beneficia cel mai mult de pe urma chelării cuprului.
Pe termen lung, integrarea unei terapii care vizează metalochimia cerebrală cu tratamente care reduc acumularea de amyloid sau cu terapii antiinflamatorii ar putea oferi sinergii terapeutice. Totuși, astfel de combinații necesită evaluări atente privind interacțiunile farmacologice, farmacocinetica și riscul cumulative de efecte adverse.
Comentariu de expert
„Țintirea homeostaziei metalelor este o strategie pragmatică și mecanistică,” spune dr. Anna Morales, neurolog și cercetător în medicină translatională, care nu a participat la studiu. „Această lucrare este încurajatoare pentru că combină o ipoteză biochimică clară cu teste preclinice etapizate — modelare moleculară, teste pe celule și evaluări comportamentale la animale. Următoarele provocări majore vor fi siguranța și eficacitatea la om, precum și identificarea subgrupurilor de pacienți care pot beneficia efectiv.”
Pașii următori și perspective clinice
Cercetătorii intenționează să avanseze L10 către studii clinice umane pentru a evalua siguranța, tolerabilitatea și potențialele beneficii cognitive. Întrebările rămase sunt multiple: cât de bine va funcționa compusul în populații diverse de pacienți? Poate fi combinat în siguranță cu alte terapii aprobate (de exemplu: inhibitori de acetilcolinesterază, antagonisti NMDA sau anticorpi monoclonali anti-amyloid)? Și cât de durabile sunt îmbunătățirile cognitive observate în modele animale?
Răspunsul la aceste întrebări va necesita studii clinice bine concepute, ghidate de biomarkeri specifici (cum ar fi nivelurile de cupru în lichidul cefalorahidian, imagistica PET pentru amyloid sau măsurile inflamatorii) și de criterii stricte de selecție a participanților. De exemplu, includerea pacienților cu dovezi biochimice de disfuncție a metabolismului cuprului ar putea crește probabilitatea de succes al unui studiu de fază II sau III.
În plus, rigurozitatea reglementară — studii toxice repetate, date farmacocinetice și farmacodinamice, precum și evaluări pe termen lung privind efectele asupra funcției hepatice sau renale — va fi esențială înainte ca L10 să poată fi considerat pentru aplicare clinică largă. Profilul de siguranță în testele preclinice este promițător, dar tranziția de la animale la oameni implică întotdeauna incertitudini importante.
Pentru moment, L10 reprezintă un candidat atractiv și cu costuri reduse, care mută accentul pe chimia metalelor din creier — un domeniu cu potențial pentru terapii țintite la un subgrup de pacienți cu Alzheimer. Ca întotdeauna, rezultatele promițătoare la animale trebuie validate în studii clinice umane înainte de orice aplicare în practică, dar studiul oferă un model clar pentru cum se poate trece de la înțelegerea moleculară la dezvoltarea unei terapii potențiale.
Contextul științific mai larg include și alte strategii emergente: dezvoltarea de chelatori selectivi pentru diferite metale (cupru, fier, zinc), proiectarea de molecule capabile să modifice interacțiunile metal-proteină fără a perturba funcțiile fiziologice ale metalelor esențiale, precum și utilizarea tehnicilor de farmacogenomică pentru a personaliza tratamentele. Convergența acestor direcții ar putea crește eficacitatea și siguranța noilor terapii pentru boala Alzheimer.
În concluzie, descoperirea legată de L10 adaugă un element important în portofoliul de cercetare Alzheimer: o abordare bazată pe reglarea cuprului cerebral, care combină rațiune mecanistică, fezabilitate sintetică și potențial de accesibilitate economică. Următoarele etape de cercetare vor clarifica dacă acest compus poate transforma speranța preclinică într-o opțiune terapeutică reală.
Sursa: sciencealert

Lasă un Comentariu