6 Minute
Celulele se bazează pe mitocondrii pentru a produce energie, iar noi cercetări leagă erorile în replicarea ADN-ului mitocondrial de creșterea inflamației cronice observate odată cu înaintarea în vârstă. O echipă de cercetători de la Max Planck Institute for Biology of Ageing și colaboratorii lor au examinat probe umane și modele murine de îmbătrânire pentru a identifica un mecanism molecular prin care mitocondriile își expulzează fragmente din propriul ADN în citoplasmă, activând astfel răspunsuri inflamatorii.
Context științific: mtDNA, nucleotide și senescență
Mitocondriile conțin propriul lor genom—mtDNA—care trebuie copiat cu mare acuratețe în timpul mentenanței și replicării. ADN-ul nuclear folosește dezoxiribonucleotide (dNTP) ca blocuri de construcție pentru replicare. Studii anterioare au arătat că rezerva de dNTP scade în celulele îmbătrânite și în cele senescente, ceea ce poate compromite sinteza corectă a ADN-ului și poate perturba homeostazia celulară.
Când dezoxiribonucleotidele devin insuficiente, polimerazele mitocondriale pot introduce din greșeală ribonucleotide (rNTP) în lanțul ADN. Incorporarea de ribonucleotide destabilizează structura dublu helcială, generând leziuni, fragmente sau copii imperfecte ale mtDNA. Organele detectează aceste structuri anormale ca fiind defectuoase și le pot elimina în citoplasmă. Odată ce mtDNA se regăsește în citosol, este recunoscut de senzori ai imunității înnăscute, ceea ce declanșează semnalizare inflamatorie ce poate contribui la afectarea țesuturilor și la fenotipuri asociate îmbătrânirii.
Designul studiului și rezultate principale
Cercetătorii au utilizat o combinație de probe de țesut uman și modele murine genetic modificate care imită declinul legat de vârstă pentru a urmări modul în care dezechilibrul nucleotidei afectează integritatea mtDNA și inflamația celulară. Folosind teste biochimice detaliate, secvențiere de înaltă precizie și analize histologice, echipa a observat rate crescute de incorporare a ribonucleotidelor în mtDNA în țesuturi îmbătrânite sau private de nucleotide. Aceste molecule mtDNA imperfecte erau mai predispuse la a fi eliminate din mitocondrii.
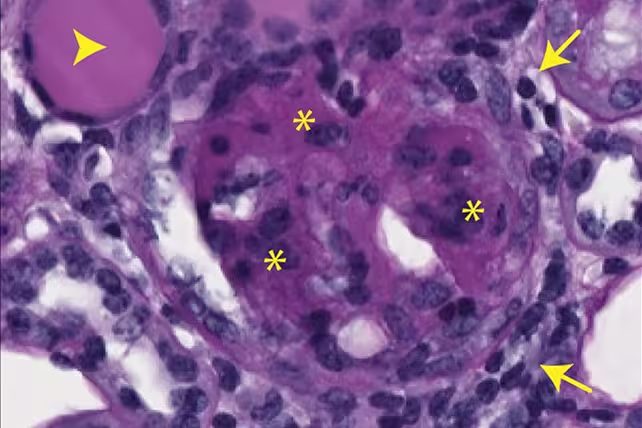
Există dovezi de cicatrizare renală la șoareci, cauzată de mtDNA expulzat. (Max Planck Institute for Biology of Ageing)
MtDNA-ul expulzat a activat căi imune asociate cu inflamația cronică și formarea de țesut cicatricial în modelele animale. În termeni mecanicisti, studiul leagă modificările metabolice—în special epuizarea rezervelor de dezoxiribonucleotide—de un lanț molecular de evenimente care conectează disfuncția mitocondrială cu fenotipuri inflamatorii observate în țesuturi îmbătrânite. În plus, analiza a identificat semne distincte ale activării căii cGAS-STING și a altor senzori citosolici, ceea ce oferă un cadru coerent pentru modul în care fragmentarea mtDNA stimulează răspunsuri de tip antiviral pro-inflamator și procese de fibroză.
Declarații notabile de la investigatori
Thomas Langer, de la Max Planck Institute for Biology of Ageing, rezumă implicația: perturbările metabolice care modifică pool-urile de nucleotide pot iniția o cascadă ce duce la inflamație în celulele senescente și în organe îmbătrânite, sugerând ținte moleculare pentru intervenție. Dusanka Milenkovic, de asemenea de la institut, subliniază că terapiile folosite în prezent pentru unele tulburări mitocondriale—administrarea de precursorii ADN—ar merita testate pentru a vedea dacă reduc și inflamația asociată vârstei. Comentariile lor indică atât posibilități terapeutice, cât și necesitatea unor studii riguroase de siguranță și eficacitate.
Implicații pentru sănătate și direcții viitoare de cercetare
Acest mecanism oferă o explicație credibilă pentru modul în care inflamația de nivel scăzut, dar persistentă, se acumulează pe parcursul decadelor și contribuie la afecțiuni frecvente legate de vârstă, inclusiv anumite tipuri de cancer, boli cardiovasculare și degenerative precum boala Alzheimer. Prin blocarea incorporării eronate a ribonucleotidelor sau prin stabilizarea mtDNA astfel încât să nu fie expulzat, ar putea fi posibilă reducerea semnalizării inflamatorii dăunătoare în țesuturile vârstnice.
Pașii cheie următori includ determinarea frecvenței cu care această cale operează în procesul normal de îmbătrânire umană comparativ cu stările patologice specifice, precum și evaluarea dacă terapiile menite să completeze pool-urile de dezoxiribonucleotide pot reduce în siguranță inflamația indusă de mtDNA fără efecte adverse. De asemenea, rămâne de explorat interacțiunea dintre această cale și procesele de calitate mitocondrială precum mitofagia, fuzia și fisiunea mitocondrială, precum și rolul controlului redox și al altor metaboliti (de exemplu, nicotinamidă, ATP/ADP ratio) în menținerea fidelității replicării mtDNA.
Pe plan clinic, conceptul de «suplimentare a precursorilor ADN» a fost folosit în contexte limitate pentru anumite ameliorări metabolice, dar traducerea către reducerea inflamației legate de vârstă necesită studii preclinice extinse. Într-un cadru de dezvoltare terapeutică, strategiile pot include: 1) aprovizionarea selectivă cu dNTP sau precursorii lor în țesutele vulnerabile; 2) inhibitori ai încorporării rNTP de către polimerazele mitocondriale; 3) boostarea mecanismelor de reparare a mtDNA sau 4) modularea semnalizării cGAS-STING pentru a tempera răspunsul inflamator fără a compromite apărarea antivirală. Fiecare abordare vine cu riscuri: perturbarea echilibrului nucleotidei poate favoriza inserții greșite sau instabilitate genomică, iar suprimarea completă a căilor imune poate crește susceptibilitatea la infecții.
O altă direcție relevantă este cartografierea tipurilor de țesut în care fenomenul este cel mai activ. Țesuturile cu rată metabolică mare și cu cerințe intense pentru ADN mitocondrial—cum ar fi mușchiul cardiac, cortexul cerebral și rinichii—ar putea fi mai sensibile la acest mecanism. Datele din studiu indică deja afectare renală la modelele murine, dar este esențială validarea în cohortele umane și în modele care recapitulează comorbidități frecvente la vârstnici (diabet, hipertensiune, dislipidemie).
Concluzie
Studiul leagă un deficit metabolic—reducerea dezoxiribonucleotidelor—de o rută moleculară clară către inflamație, prin instabilitatea și expulzarea mtDNA. Aceste descoperiri deschid noi căi pentru strategii țintite menite să păstreze integritatea genomului mitocondrial și, eventual, să tempereze declinul legat de inflamație în populațiile îmbătrânite. Vor fi necesare cercetări preclinice și clinice suplimentare pentru a evalua dacă suplimentarea cu nucleotide sau alte intervenții pot genera beneficii tangibile pentru sănătatea persoanelor în vârstă, ținând cont de raportul beneficiu/risc și de efectele pe termen lung.
Sursa: sciencealert

Lasă un Comentariu