10 Minute
Artrita reumatoidă (AR) poate începe cu mult înainte ca umflarea dureroasă a articulațiilor să devină evidentă. Cercetări recente arată că modificări imune caracteristice — detectabile în sânge cu ani înainte de apariția sinovitei clinice — marchează o etapă silențioasă în care activitatea autoimună se intensifică treptat. Identificarea acestor biomarkeri timpurii oferă posibilitatea de a îmbunătăți predicția de risc, de a iniția tratamente mai devreme și, în final, de a reduce leziunile articulare care definesc AR.
Context: autoimunitate silențioasă și ACPAs
Artrita reumatoidă este o boală autoimună în care sistemul imunitar atacă țesuturile articulare, provocând inflamație cronică, durere și deteriorare progresivă. Inflamația articulară clinic detectabilă este denumită sinovită. Înainte ca sinovita să devină evidentă clinic, anumite persoane pot avea deja în sânge autoanticorpi specifici, numiți anticorpi anti-proteine citrulinate (ACPAs). ACPAs sunt asociate cu un risc crescut de dezvoltare a AR, dar majoritatea persoanelor pozitive pentru ACPA nu dezvoltă imediat boala activă. De aceea, pașii biologici care transformă această autoimunitate „tăcută” într-o artrită reumatoidă manifestă au rămas până acum insuficient clarificați.
În plus, prezența ACPAs nu este o sentință inevitabilă: factorii genetici (cum ar fi anumite alele HLA-DRB1), expunerile de mediu (fumat, microbiomul oral sau pulmonar modificat), comorbiditățile și profilul imun al individului contribuie în mod complex la riscul real de progresie. În consecință, eforturile actuale se concentrează nu doar pe detectarea ACPAs, ci și pe înțelegerea combinațiilor de semnale biologice care indică o tranziție spre boală clinică, astfel încât intervențiile să poată fi direcționate către acei pacienți cu risc cu adevărat crescut.
Designul studiului și metode
O echipă americană condusă de cercetători de la Allen Institute for Immunology, University of California San Diego și University of Colorado Anschutz a urmărit un grup de persoane pozitive pentru ACPA pentru a cartografia schimbările imunologice care preced AR. Cohorta a cuprins 45 de persoane considerate în risc din cauza prezenței ACPAs în sânge; dintre acestea, 16 au dezvoltat ulterior artrită reumatoidă clinică. Datele obținute de la persoane sănătoase au servit ca puncte de comparație pentru a evidenția semnături imune specifice stadiului de risc.
Investigarea a combinat mai multe abordări complementare: proteomică sanguină pentru măsurarea proteinelor asociate inflamației, profilare celulară detaliată a populațiilor imune folosind citometrie și secvențiere, precum și analize funcționale ale limfocitelor B și T. Prin integrarea acestor straturi de date, cercetătorii au construit o cronologie a activării imune în timpul fazei la risc. Acest demers a implicat tehnici moderne, precum paneluri de proteine multiple (multiplex cytokine/chemokine), analiză de expresie genică la nivel unic (single-cell RNA-seq) și teste funcționale care evaluează capacitatea celulelor B de a produce anticorpi sau a celulelor T de a răspunde la antigen.
De asemenea, metodologia a inclus controale statistice riguroase pentru a diferenția semnătura specifică AR de variațiile interindividuale și de factorii de confuzie, cum ar fi vârsta, sexul, istoricul medical și tratamentele concomitente. Urmărirea pe termen lung a participanților a permis detectarea momentului în care semnalele imune evoluează și, eventual, prezic progresia către boala clinică.
Descoperiri cheie
Studiul a identificat o creștere clară a proteinelor inflamatorii și a activității imune la participanții pozitivi pentru ACPA în comparație cu controlul sănătos. În mod particular, proteine implicate în semnalizarea imună atât innate, cât și adaptive erau mai abundente și mai active. Exemplele includ citokine proinflamatorii, chemokine care atrag celule inflamatorii la țesuturi, componente ale căii complementului și markeri ai activării macrofagelor și a celulelor dendritice.
Analizele limfocitare au arătat că atât celulele B (producătoare de anticorpi), cât și celulele T (care coordonează răspunsurile B) au trecut spre o stare mai „primed”, adică pregătite pentru răspunsuri inflamatorii intense. Această primare se traducea printr-o frecvență crescută a subseturilor celulare cu potențial patologic: de exemplu, celule T helper foliculare (Tfh) care sprijină maturarea celulelor B și producția de ACPAs, sau populații T cu fenotip proinflamator (cum ar fi Th17) care favorizează inflamația cronică articulară. În paralel, s-au observat modificări în repertoriul celular B: clonuri B cu hipermutare somatică activă și capacitate sporită de a produce anticorpi de înaltă afinitate împotriva antigenelor citrulinate.
Pe măsură ce indivizii se apropiau de diagnosticul clinic de AR, frecvența celulelor T și B predispuse la răspunsuri inflamatorii a crescut, iar unele populații celulare care, în mod obișnuit, manifestă fenotipuri mai puțin inflamatorii s-au transformat spre stări mai agresive. Acest lucru sugerează o rearanjare funcțională și cantitativă a sistemului imunitar, nu doar o simplă prezență de anticorpi. În termeni practici, autorii au detectat o semnătură emergentă a inflamației care reflectă interacțiuni crescute între componente innnate și adaptive ale imunității, creând un mediu propice pentru dezvoltarea sinovitei.
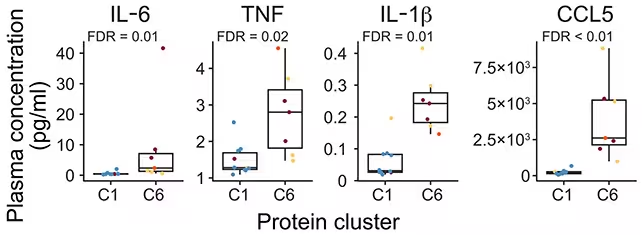
Proteinele inflamatorii au fost mai abundente într-un grup format preponderent din persoane cu risc de artrită (C6). (He et al., Sci. Transl. Med., 2025)
Existau suprapuneri între cei care au progresat și cei care nu au progresat la AR, însă semnătura emergentă clarifică modul în care stadiul la risc evoluează biologic către boala clinică. Autorii notează că „Rezultatele noastre susțin conceptul că boala inflamatorie a AR începe mult înainte de debutul sinovitei active, mai devreme decât s-a apreciat clinic.” Această afirmație subliniază faptul că oportunitățile pentru intervenție pot exista cu mult înainte de instalarea simptomelor articulare evidente.
Implicații pentru diagnostic și tratament
Înțelegerea semnalelor imune care prevestesc progresia către AR deschide mai multe direcții promițătoare. În primul rând, panourile care combină proteine inflamatorii și markeri de tip celular ar putea rafina stratificarea riscului în rândul persoanelor pozitive pentru ACPA, oferind predicții mai precise decât simpla prezență a anticorpilor. Un astfel de algoritm multifactorial ar putea integra nivelurile de citokine, chemoreceptori, frecvența anumitor subseturi de limfocite și parametri genetici pentru a produce un scor de risc util clinic.
În al doilea rând, intervențiile administrate în această fereastră preclinică ar putea preveni sau întârzia apariția sinovitei și a leziunilor articulare. Există deja dovezi că medicamente imunomodulatoare pot influența cursul imunologic înainte de boala clară: abatacept, un agent care imită CTLA-4 și blochează co-stimularea limfocitelor T, este folosit în unele studii pentru a amâna debutul AR la pacienții cu risc crescut și are dovezi că inversează anumite aspecte ale activării imune identificate în acest studiu. Mecanismul său, limitând activarea celulelor T și, implicit, ajutorul acordat celulelor B pentru producția de autoanticorpi, face ca abatacept să fie un candidat logic pentru intervenție timpurie.
Totuși, transformarea acestor descoperiri în practică clinică ridică provocări importante: evaluarea beneficiilor versus riscurile expunerii la terapie imunomodulatoare la persoane care încă nu prezintă boală activă; costurile și accesibilitatea testelor avansate de biomarkeri; și necesitatea unor studii randomizate, controlate, care să demonstreze reducerea evenimentelor clinice relevante (de exemplu, apariția sinovitei sau reducerea lezării articulare pe imagistică). În plus, considerente etice privind etichetarea „la risc” a unor persoane sănătoase trebuie gestionate cu grijă, inclusiv consiliere genetică și informare despre incertitudinile prognostice.
Kevin Deane, reumatolog la CU Anschutz, este citat de echipa de cercetare subliniind că rezultatele „ar putea susține studii suplimentare … pentru a prezice mai bine cine va face AR, a identifica ținte biologice potențiale pentru prevenție, precum și a găsi modalități de a îmbunătăți tratamentele.” Aceasta reflectă atât potențialul clinic, cât și necesitatea validării extinse înainte de a schimba practicile medicale curente.
Limitări și direcții viitoare
Deși descoperirile sunt convingătoare, există limitări inerente. Mărimea relativ mică a cohortei și distribuția variabilă a factorilor de risc pot restrânge generalizarea rezultatelor. Supravegherea pe termen mai lung și replicarea în populații diverse, cu diferite predispoziții genetice și expuneri de mediu, sunt esențiale. În plus, detectarea unor semnături imune în sânge nu indică întotdeauna locația precisă a inițierii inflamației — de exemplu, inițiatorii pot rezida la nivelul mucoaselor (plămâni, cavitate orală) sau în organe limfoide, înainte ca efectele să devină evidente la nivelul articulațiilor.
Viitoarele cercetări trebuie să clarifice care combinații de markeri conferă cel mai mare valoare predictivă, să dezvolte algoritmi clinici practici și să stabilească praguri care să informeze decizii terapeutice. Integrarea datelor - proteomică, transcriptomică, epigenetică și clinico-demografică - va fi probabil cheia pentru a crea modele robuste de predicție. De asemenea, este important să se evalueze intervenții non-farmacologice sau de mediu (de exemplu, renunțarea la fumat, controlul infecțiilor orale) ca strategii complementare de reducere a riscului.
Concluzie
Această cercetare conturează o fază preclinică a AR caracterizată prin creșterea proteinelor inflamatorii și printr-o activare tot mai pronunțată a celulelor B și T. Deși modificările terapeutice bazate pe acești biomarkeri vor necesita trialuri suplimentare, identificarea semnalelor timpurii măsurabile deplasează domeniul către strategii proactive și preventive care ar putea limita durerea și dizabilitatea asociate artritei reumatoide. Pe termen lung, combinarea unei screening precise cu intervenții țintite ar putea transforma managementul AR din reacțional în preventiv, reducând impactul acestei boli asupra calității vieții pacienților.
Sursa: sciencealert

Lasă un Comentariu