9 Minute
Prenatal environment and lifelong anxiety risk
Lucrări experimentale recente la șoareci sugerează că vulnerabilitatea la anxietate în viața adultă poate avea origini înainte de naștere. Cercetătorii de la Weill Cornell Medicine raportează că infecția maternă sau stresul în timpul sarcinii pot lăsa urme moleculare și la nivelul circuitelor cerebrale în creierul urmașilor, generând un risc crescut de comportamente de tip anxios pe termen lung. Studiul identifică modificări specifice în girozității dentate ventrale (vDG), o subregiune a hipocampului implicată în evaluarea și evitarea amenințărilor, și le leagă de reprogamarea epigenetică a reglării genice neuronale.
Study design: modeling maternal inflammation
Pentru a investiga cum afectează adversitatea prenatală dezvoltarea creierului, echipa a folosit modele de șoareci genetic modificați care reproduc semnalizarea inflamatorie crescută la o mamă gestantă. Această abordare recreează aspecte ale infecției materne sau ale stresului fiziologic susținut fără a transmite direct puiilor gene ale răspunsului la stres modificate. Investigațiile au urmărit descendenții până la vârsta adultă și au analizat comportamentul, activitatea neurală și modificările ADN-ului în regiuni cerebrale țintă.
Cercetătorii s-au concentrat în special pe puii masculi pentru testele comportamentale, deoarece în modelul lor aceștia au manifestat comportamente de anxietate mai pronunțate. Deși puii erau din punct de vedere genetic normali (nu au moștenit predispoziția inflamatorie introdusă experimental), în viața adultă au prezentat semne stabile de anxietate crescută — cum ar fi preferința puternică pentru spații închise și evitarea zonelor deschise — comparativ cu animalele de control.
Neural circuits: overactive neurons in the ventral dentate gyrus
Când au fost puși în situații de amenințare, șoarecii afectați au manifestat activare excesivă într-un subset de neuroni din girozitatea dentată ventrală (vDG). vDG are un rol central în evaluarea potențialelor amenințări din mediu și în reglarea răspunsurilor comportamentale; hiperactivarea în această zonă poate amplifica semnalele de pericol și poate înclina animalele spre evitarea repetată. Autorii studiului descriu cum adversitatea prenatală a lăsat amprente durabile asupra neuronilor vDG, schimbând modul în care aceste celule reacționează la contexte nesigure în viața adultă.
Acest tip de modificare circuitală nu înseamnă că întregul hipocamp este perturbat, ci că o populație relativ restrânsă de neuroni devine mai predispusă la reacții exagerate. Astfel se poate explica de ce un comportament specific — evitarea și hipersensibilitatea la stres — apare chiar și atunci când capacitatea generală de învățare sau memoria rămân relativ intacte. Această disociere între funcții cognitive și răspunsuri emoționale este importantă pentru înțelegerea tulburărilor de anxietate.
"Our data reveal prenatal adversity left lasting imprints on the neurons of the vDG, linking gestational environment to anxiety-like behavior," a spus neurofarmacologul Miklos Toth, co-autor al lucrării. "This mechanism may help explain the persistent stress sensitivity and avoidance seen in some individuals with innate anxiety." Tradus și adaptat, comentariul subliniază că experiențele gestationale pot configura, prin mecanisme moleculare și circuitale, sensibilitatea la stres pe termen lung.
Epigenetic reprogramming: DNA methylation and gene expression
Pentru a explora mecanismele moleculare, cercetătorii au măsurat tiparele de metilare a ADN-ului în țesut neuronal provenit din vDG. Metilarea ADN este o etichetă epigenetică care poate suprima sau modula activitatea unui gene fără a schimba secvența ADN-ului în sine. Echipa a descoperit mii de situri diferențial metilate în vDG la șoarecii expuși prenatal la stres, concentrate în special în regiuni genice care reglează comunicarea sinaptică și excitabilitatea neuronală.
Aceste modificări epigenetice nu erau răspândite uniform, ci erau localizate într-o mică fracțiune din neuronii din vDG. "Un șoarece poate avea aproape 400.000 de celule în vDG, dar doar câteva mii sunt afectate în timpul sarcinii", a remarcat Toth. Când au fost plasați într-un context amenințător, neuronii reprogramați au manifestat o activitate amplificată — un rezultat coerent cu ideea unui circuit pregătit să supraestimeze pericolul și să favorizeze evitarea.
Kristen Pleil, neurocercetător molecular și co-autor, a rezumat consecința funcțională: "Per ansamblu, aceste schimbări epigenetice instruiesc anumite neuroni din vDG să răspundă diferit în viața adultă când se confruntă cu medii nesigure. Neuronii prezintă o activitate excesivă, contribuind la percepția mediului ca fiind mai amenințător decât este în realitate." Această formulare evidențiază relația directă dintre marca epigenetică și fenotipul comportamental observat.
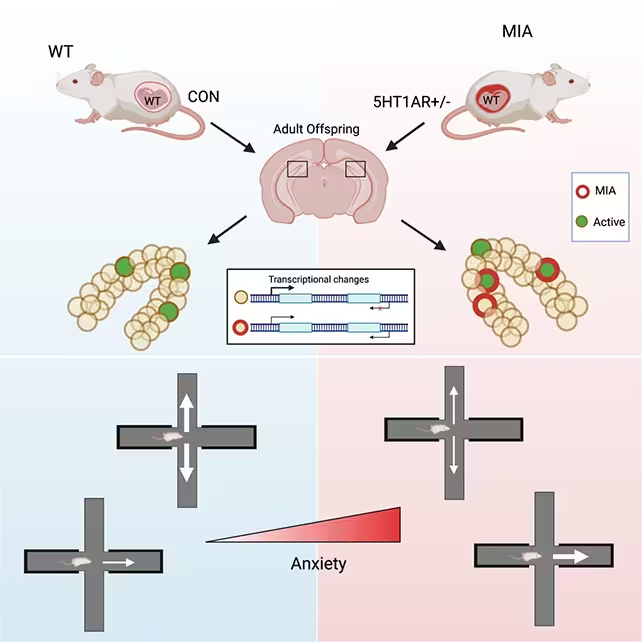
Șoarecii expuși la stres în uter au fost demonstrați a fi mai anxioși în viața adultă.
Scientific context and implications
Tulburările de anxietate se află printre cele mai frecvente afecțiuni de sănătate mintală la nivel global; studiile epidemiologice sugerează că aproape una din trei persoane poate experimenta anxietate clinic semnificativă pe parcursul vieții. Cercetări anterioare, atât la oameni, cât și la animale, au legat sănătatea prenatală — precum infecțiile materne, nutriția deficitară sau stresul — cu rate crescute ale tulburărilor de dispoziție și anxietate la descendenți. Noua lucrare pe șoareci identifică un lanț mecanistic plauzibil: inflamația maternă → modificări epigenetice țintite într-un circuit de evaluare a amenințării → hipersensibilitate la stres și comportament de evitare pe termen lung.
Prin cartografierea atât a hiperactivității la nivel de circuit, cât și a modificărilor de metilare a ADN-ului asociate, cercetarea adaugă dovezi la un corp tot mai mare care arată că mediile timpurii pot programa funcția cerebrală prin etichete moleculare stabile. Aceasta deschide două direcții promițătoare: posibilitatea identificării unor biomarkeri diagnostici — semnături epigenetice detectabile în țesuturi accesibile precum sângele — și dezvoltarea unor terapii țintite care să inverseze priming-ul circuitelor maladaptative.
De exemplu, dacă anumite modele de metilare sunt repetabile și detectabile în probe periferice, ele ar putea servi ca indicatori de risc pentru intervenții preventive în copilărie sau adolescență. De asemenea, strategiile terapeutice ar putea varia de la farmacologie care restabilește echilibrul excitabilității neuronale, la intervenții comportamentale timpurii sau terapii epigenetice emergente care vizează modificările chimice ale ADN-ului. Toate aceste opțiuni necesită studii riguroase pentru a evalua siguranța și eficacitatea pe termen lung.
Future directions and translational challenges
Autorii subliniază limitările importante: rezultatele provin din modele controlate pe șoareci, iar translatarea la oameni trebuie făcută cu prudență. Întrebările cheie rămân: de ce doar un subset de neuroni din vDG dobândește mărcile epigenetice; dacă semnături de metilare comparabile apar în țesuturi periferice ușor de prelevat; și în ce ferestre de dezvoltare este creierul cel mai sensibil la inflamația maternă. Echipa intenționează să cartografieze perioadele fetale critice cele mai vulnerabile la inflamație maternă și să testeze intervenții care ar putea normaliza activitatea vDG și comportamentul.
Pe plan translational, există provocări practice și etice: extrapolarea corectă a dozelor și a duratei expunerii, diferențele între sistemele imunitare și dezvoltarea neurocognitivă ale speciei, precum și riscul de supraintervenție în sarcină. Este esențial ca propunerile de intervenție să fie evaluate în mai multe modele preclinice și, ulterior, în studii observaționale longitudinale la oameni. În plus, definirea biomarkerilor periferici necesită protocoale standardizate pentru recoltare și analiză, pentru a asigura reproducibilitate între laboratoare.
Din punctul de vedere al sănătății publice, studiul întărește importanța îngrijirii prenatale adecvate și a controlului infecțiilor în sarcină. De asemenea, scoate în evidență faptul că schimbări subtile în mediul gestațional pot produce modificări durabile în circuitele neuronale, modelând tendințele comportamentale chiar și la decenii după naștere. Acest tip de informație poate influența politici de sănătate publică, prioritizând prevenția și suportul perinatal.
Expert Insight
"This work is an elegant example of how prenatal conditions can sculpt specific neural circuits through epigenetic mechanisms," spune Dr. Elena Vargas, neurocercetător în dezvoltare, care nu a fost implicată în studiu. "While the jump to human anxiety disorders is nontrivial, the combination of behavioral assays, circuit mapping, and DNA methylation profiling in one study strengthens the biological plausibility. Future translational steps should focus on identifying peripheral biomarkers and defining therapeutic windows for intervention." În română, expertiza subliniază eleganța integrării multiplilor nivele de analiză — de la comportament la circuit la epigenetică — și recomandă direcții clare pentru traducerea către clinică.
Conclusion
Studiul de la Weill Cornell oferă dovezi mecanistice că inflamația maternă în timpul sarcinii poate predispose descendenții la anxietate crescută prin reprogramarea unei populații discrete de neuroni în girozitatea dentată ventrală. Deși aceste descoperiri sunt demonstrate la șoareci, ele clarifică modul în care experiențele prenatale pot lăsa amprente moleculare și la nivelul circuitelor care influențează comportamentul. Pentru a avansa spre aplicații clinice, sunt necesare studii care să verifice prezența unor semnături epigenetice similare la oameni, să identifice biomarkeri periferici reproductibili și să definească ferestrele terapeutice optime, astfel încât riscul de anxietate pe durata vieții să poată fi redus eficient.
Sursa: sciencealert

Lasă un Comentariu