8 Minute
Cercetătorii au dezvoltat o metodă de inginerie celulară care reduce dramatic cantitatea de vector viral necesară pentru a produce celule natural killer induse echipate cu receptor chimic (CAR) — numite iNK. Această avansare promite să scadă costurile și să îmbunătățească scalabilitatea terapiilor imunologice bazate pe CAR, păstrând în același timp o activitate anti-tumorală puternică în modele preclinice. Descoperirea are implicații directe pentru dezvoltarea terapiei celulare, accesibilitatea terapiilor „off-the-shelf” și strategiile de producție GMP, contribuind la reducerea barierelor economice și operaționale asociate cu vectorii virali.
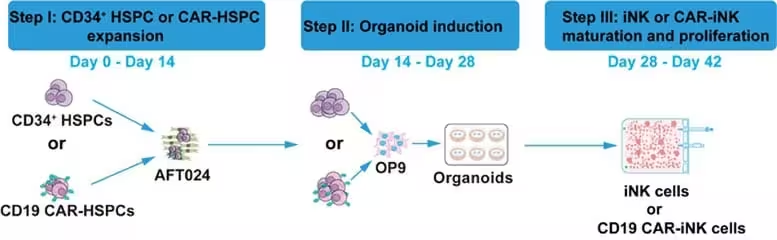
Modul în care noua tehnică reduce cererea de vectori virali
Ingineria tradițională a celulelor NK mature cu receptori CAR solicită de obicei cantități substanțiale de vector viral pentru a introduce gena receptorului în mod eficient. În contrast, abordarea descrisă se aplică în timpul fazei de inducere a celulelor iNK — adică în momentul în care celulele stem sau precursorii sunt diferențiați spre profilul NK — și a redus aportul de vector cu factori enormi în comparație cu protocoalele standard. Autori ai studiului raportează reduceri estimate de ordinul 1:140.000 până în a șasea săptămână de cultură și chiar de aproximativ 1:600.000 până în săptămâna a șaptea. În termeni practici, cercetătorii au obținut expresie comparabilă a CAR utilizând doar o fracțiune foarte mică din materialul viral necesar în mod normal.
Aceste reduceri se pot traduce prin scăderea multiplicării dozei multiplicative (MOI) folosite la transducție, prin optimizarea momentului biologic în care celulele sunt mai susceptibile la integrarea genetică sau prin selectarea unui stadiu de diferențiere în care receptorul CAR este stabil exprimat pe suprafața celulară. Deși mecanismul exact poate varia în funcție de tipul de vector folosit (de exemplu lentivirus versus retrovirus) și de condițiile de cultură (medii, citokine, factori de creștere), rezultatele sugerează că o perioadă de inducție bine calibrată poate crește eficiența transducției și poate permite folosirea unor doze virale mult mai mici fără a compromite nivelul de expresie al CAR.
Reducerea cererii de vectori virali nu înseamnă doar economie de material biologic: implică și diminuarea expunerii tehnicienilor la agenți biologici, simplificarea procedurilor de control al calității și posibilitatea de a realiza mai multe loturi GMP din aceeași producție de vector. În plus, o eficiență mai mare a ingineriei în stadiile timpurii poate duce la o populație celulară mai omogenă din punct de vedere al expresiei CAR, ceea ce este important pentru consistența produsului final, pentru predictibilitatea răspunsului terapeutic și pentru conformitatea cu cerințele reglementatorii.
Teste funcționale: controlul tumorii în modele de leucemie
Reducerea utilizării vectorilor nu ar fi relevantă dacă funcția antitumorală a celulelor modificate ar fi compromisă. Într-o serie de teste preclinice, atât celulele iNK ne-modificate, cât și variantele modificate cu CAR (CAR-iNK) au demonstrat citotoxicitate semnificativă împotriva celulelor canceroase în teste in vitro standard, cum ar fi testele de co-cultură, asay-urile de eliberare a LDH și măsurătorile apoptotice prin citometrie în flux. Aceste rezultate confirmă că procesul de inducție și transducție menține capabilitățile efectorii naturale ale celulelor NK, inclusiv citotoxicitatea mediată prin receptorii inerți și capacitatea de a elimina celule țintă.
Mai important, în modele murine preclinice — incluzând xenogrefe derivate din linii celulare (CDX) și xenogrefe derivate din pacienți (PDX) ale leucemiei acute limfoblastice cu celule B umane (B-ALL) — celulele CAR-iNK orientate împotriva antigenului CD19 au încetinit progresia tumorală și au prelungit supraviețuirea comparativ cu grupurile de control. Aceste studii au folosit măsurători seriale ale volumului tumoral, imagistică bioluminescentă și evaluări asupra stării clinice a animalelor, oferind un tablou coerent al eficacității în modele relevante pentru boala umană.
În plus, testele funcționale au evaluat biomarkeri ai activării celulare (de exemplu CD107a, IFN-γ, TNF-α) și au urmărit persistența celulelor adoptate pe parcursul experimentelor. Datele sugerează că, pe lângă capacitatea de citotoxicitate imediată, CAR-iNK pot menține o activitate suficientă pentru a produce un efect terapeutic durabil pe durata observării în modelele animale. Totuși, pentru a traduce aceste rezultate în contexte clinice, este esențială monitorizarea atentă a profilelor de siguranță, a potențialelor reacții inflamatorii și a riscurilor asociate cu integrarea genetică.
De ce contează aceasta pentru dezvoltarea terapiei celulare
Vectorii virali reprezintă unul dintre cele mai costisitoare componente în fabricarea celulelor CAR. Producția la standarde GMP, purificarea, testarea decontaminării, stocarea și transportul vectorilor implică investiții semnificative și logistică complexă. Reducerea necesarului de vectori cu ordine de mărime aduce două beneficii imediate: scăderea costurilor de fabricație și reducerea poverii legate de biosiguranță în timpul procesului de scalare. Aceste avantaje pot accelera tranziția de la laboratoare spre studiile clinice și pot facilita extinderea capacității de producție pentru terapii celulare adoptive.
Impactul economic este dublu: pe de o parte, costul per doză de terapie scade, ceea ce îl face mai accesibil sistemelor de sănătate; pe de altă parte, companiile și centrele de producție pot distribui resursele disponibile pentru optimizarea altor componente critice, cum ar fi validarea calității, controlul loturilor și dezvoltarea formulărilor de conservare pentru produse „off-the-shelf”. În plus, reducerea cantității de material viral scade cerințele de infrastructură (de exemplu camere curate și zone de manipulare de nivel înalt), ceea ce poate accelera extinderea geografică a producției la centru clinice sau regionale.
Din perspectivă științifică și reglementară, producția eficientă și reproductibilă a CAR-iNK cu cantități minime de vector implică o politică mai clară privind evaluarea riscului de inserție, caracterizarea produsului și strategii pentru monitorizarea pe termen lung a pacienților. Faptul că aceleași efecte terapeutice au fost obținute cu mult mai puțin material viral întărește argumentele pentru explorarea unor modele de business orientate spre produse allogene (off-the-shelf) care pot fi depozitate și distribuite mai ușor decât terapiile autologe personalizate.
Implicații și pașii următori
Rezultatele raportate sunt încă preclinice, dar ele indică o cale clară către o inginerie CAR mai eficientă care păstrează potența terapeutică. Următorii pași vor include confirmarea durabilității expresiei CAR, evaluarea profilului de siguranță pe termen lung și testarea performanței în studii pe animale mari, mai apropiate ca fiziologie de om, urmate de studii clinice de fază I pentru a stabili doza, tolerabilitatea și semnele preliminare de eficacitate.
Mai multe aspecte tehnice și operaționale trebuie abordate înainte de adoptarea clinică pe scară largă. Printre acestea se numără standardizarea protocoalelor de inducție iNK, selectarea și validarea tipului optim de vector (lentiviral versus alternative non-virale cum ar fi transpozoni sau ARN mesager pentru exprimare tranzitorie), testele de inserție pentru a minimiza riscul de mutageneză inserțională și stabilirea unor criterii ferme pentru controlul calității loturilor. De asemenea, este importantă explorarea țintelor alternative la CD19 — cum ar fi antigene exprimate pe alte tumori hematologice sau chiar tumori solide — pentru a extinde aria de aplicare a platformei CAR-iNK.
Pe plan clinic, succesul va depinde nu doar de eficacitate, ci și de profilul de siguranță și de capacitatea de a integra terapia în fluxurile de îngrijire existente. Strategii combinate potențiale includ administrația CAR-iNK în combinație cu anticorpi monoclonali, blocarea punctelor de control imun (checkpoint inhibitors) sau terapii citotoxice standard, pentru a maximiza răspunsul terapeutic și pentru a preveni recurența. Pași suplimentari includ optimizarea condițiilor de stocare și livrare pentru produsele allogene, dezvoltarea unor biomarkeri de răspuns și rezistență și ajustarea designului studiilor clinice pentru a demonstra clar beneficiile clinice și economice.
În concluzie, dacă următoarele etape preclinice și studiile clinice timpurii confirmă datele inițiale, comunitatea medicală ar putea beneficia în curând de o platformă eficientă, accesibilă și scalabilă de celule NK modificate cu CAR, care să vizeze CD19 și alte antigene tumorale. Această abordare ar putea accelera accesul pacienților la terapii inovatoare, reducând în același timp complexitatea și costurile asociate producției de celule terapeutice bazate pe vectori virali.
Sursa: scitechdaily

Lasă un Comentariu