10 Minute
Cercetători de la University of Vermont au identificat o surprinzătoare frână moleculară asupra senzorilor de presiune din vasele de sânge cerebrale — iar refacerea acestei frâne ar putea deveni o cale nouă de tratament pentru reducerea fluxului sanguin cerebral și pentru anumite forme de demență. Descoperirea indică un fosfolipid de membrană numit PIP2 ca un posibil buton terapeutic pentru normalizarea circulației și protejarea funcției cerebrale.
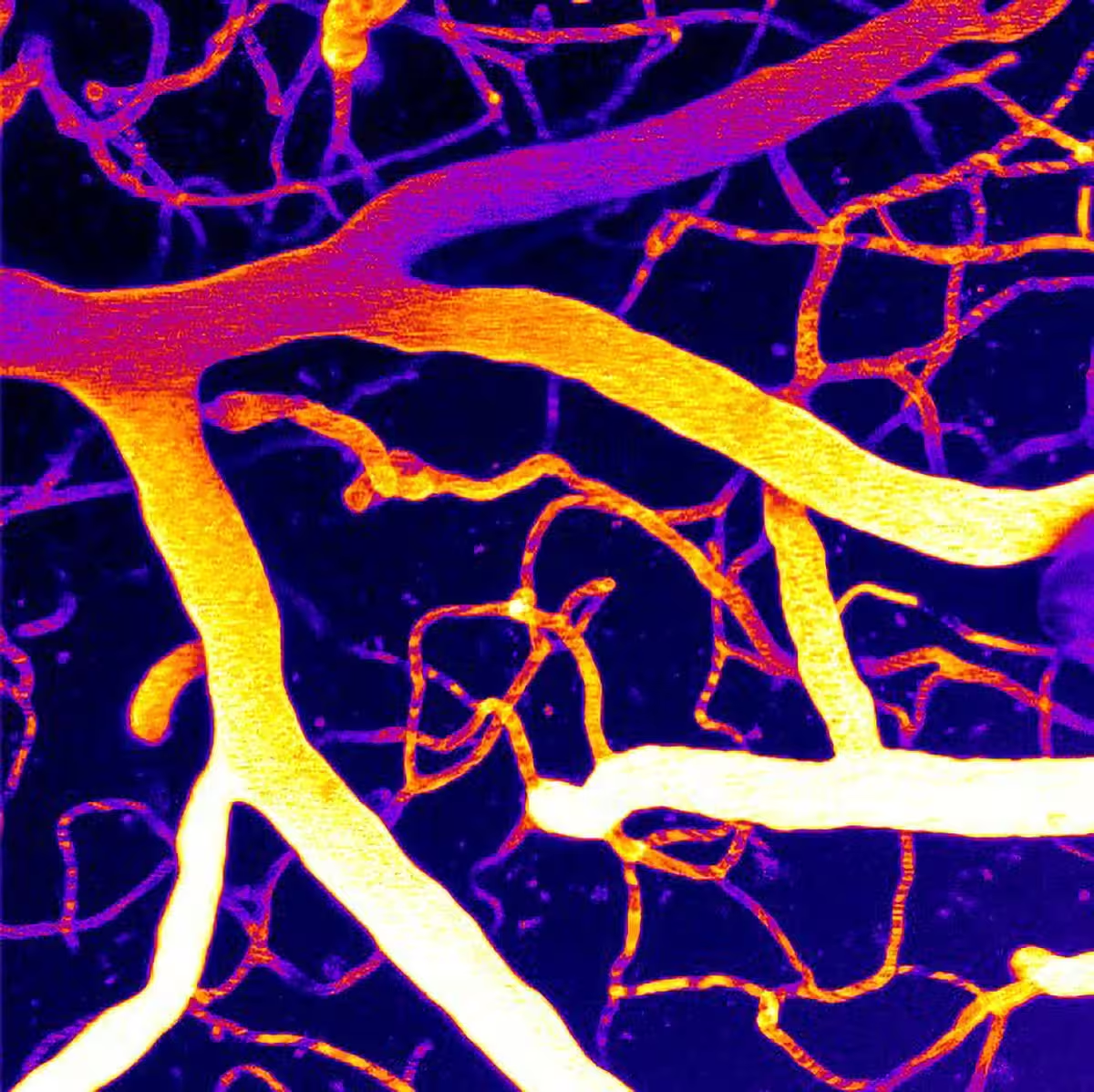
Microvasculatura cerebrală, imaginată cu microscopie cu scanare laser în două fotoni.
Cum un fosfolipid de membrană menține fluxul sanguin cerebral stabil
Mentinerea unui flux sanguin stabil în creier depinde de semnale fin reglate între sânge, pereţii vasculari şi ţesutul neural din jur. În centrul acestui control se află canalul ionic mecanosensibil Piezo1, exprimat în celulele vasculare. Piezo1 se deschide ca răspuns la forţele mecanice generate de fluxul sanguin şi ajută vasele să-şi adapteze tonusul şi diametrul în funcţie de necesităţile metabolice ale ţesutului cerebral.
În lucrări preclinice publicate în Proceedings of the National Academy of Sciences, echipa condusă de Osama Harraz, Ph.D., de la Larner College of Medicine a arătat că activitatea Piezo1 poate rămâne necontrolată atunci când un fosfolipid de membrană numit fosfatidilinozitol 4,5-bisfosfat (PIP2) este epuizat. PIP2 reglează numeroase canale ionice şi căi de transducţie a semnalului; în acest context, funcţionează ca un inhibitor natural al Piezo1: la scăderea nivelurilor de PIP2, Piezo1 devine hiperactiv şi perturbă fluxul sanguin cerebral.
Acest mecanism adaugă o piesă importantă la înţelegerea modului în care tensiunea mecanică la nivelul endotelului şi al celulelor musculare netede vasculare este transformată în semnalizare ionicǎ. Descoperirea conectează două entităţi cheie în biologia neurovasculară: fosfolipidele de membrană (în special PIP2) şi canalele ionice mecanosensibile (Piezo1), sugerând că interacţiunile lipid–proteină pot avea un impact critic asupra microcirculaţiei cerebrale.
Detalii mecanice şi implicaţii pentru homeostazie
Din punct de vedere biofizic, modul în care PIP2 influenţează Piezo1 poate fi multifactorial. PIP2 poate interacţiona direct cu anumite domenii proteice ale canalului, stabilizând conformaţii mai puţin permeabile, sau poate modifica proprietăţile fizice locale ale membranei — precum tensiunea de suprafaţă, curburile lipidice şi microdomeniile lipidice — care la rândul lor reglează probabilitatea de deschidere a porii canalului.
În plus, PIP2 este implicat în transducţia semnalelor downstream, inclusiv în activarea sau inhibarea kinazelor şi a altor proteine de scaffold care pot modula fenotipul vaselor. Astfel, epuizarea PIP2 nu afectează doar proprietatea mecanosensibilă a Piezo1, ci poate avea efecte în cascadă asupra reglării tonusului vascular, a contractilităţii şi a comunicării endotelio-mioasă.
De la eprubetă la circulaţie mai bună: refacerea PIP2
Folosind modele animale, Harraz şi colegii au testat dacă reîncărcarea PIP2 poate tempera activitatea Piezo1 şi poate restabili fluxul sanguin normal. În experimente care au combinat electrofiziologie, imagistică vasculară şi măsurători de perfuzie cerebrală, restaurarea PIP2 a suprimat activitatea excesivă a Piezo1 şi a ajutat la normalizarea microcirculaţiei cerebrale.
Metodele folosite includ administrarea unor precursoare sau mimetici ai PIP2 la nivel local în regiuni cerebrale ţintă, utilizarea vectorilor genetici pentru a creşte enzimele implicate în sinteza PIP2 şi teste farmacologice cu metaboliţi care limitează degradarea PIP2. Rezultatele au arătat îmbunătăţiri în parametrii de perfuzie cerebrală — precum debitul sanguin regional, viteza de curgere capilară şi autorreglarea locală — indicatori frecvent compromişi în demenţă.
Imaginea funcţională a microvasculaturii, obţinută prin tehnici avansate (de exemplu, microscopie în două fotoni şi imagistică prin rezonanţă magnetică funcţională la rezoluţie microvasculară), a confirmat o recuperare parţială sau completă a arhitecturii fluxului în regiunile tratate. Pe lângă parametrii hemodinamici, unele experimente comportamentale la animale au indicat îmbunătăţiri subtile ale funcţiei cognitive, corelate cu revenirea perfuziei.
„Această descoperire reprezintă un pas uriaş înainte în eforturile noastre de prevenire a demenţei şi a bolilor neurovasculare,” a declarat Harraz. „Descoperim mecanismele complexe ale acestor afecţiuni devastatoare şi acum putem începe să concepem strategii de translaţie a acestor date biologice în terapii.”
De ce contează pentru boala Alzheimer şi demenţele conexe
Boala Alzheimer şi demenţele asociate afectează în prezent zeci de milioane de oameni la nivel global, iar disfuncţia vasculară este tot mai recunoscută ca un contributor major la declinul cognitiv. Reducerea fluxului sanguin cerebral, eliminarea deficitară a produselor metabolice (inclusiv a peptidei beta-amiloid), şi deteriorarea microvasculară cronică accelerează disfuncţia neuronală şi sinaptică.
Munca de la UVM conectează o succesiune mecanică: pierderea PIP2 → activitate necontrolată a Piezo1 în celulele vasculare cerebrale → perturbarea fluxului sanguin cerebral → posibila agravare a simptomelor de demenţă. Prin ţintirea nivelurilor de PIP2 sau a funcţiei Piezo1, cercetătorii speră să restabilească reglarea vasculară necesară pentru a furniza oxigen şi nutrienţi tesutului cerebral, dar şi pentru a menţine un ecosistem propice eliminării reziduurilor metabolice.
Această abordare ar putea funcţiona complementar cu strategiile orientate spre proteinele patologice clasice (ex. anti-amiloid, anti-tau), deoarece vascularizarea adecvată şi clearance-ul interstiţial sunt critice pentru eficacitatea acestor terapii. De exemplu, îmbunătăţirea perfuziei şi a funcţiei endoteliale poate facilita transportul medicamentelor şi a sistemelor imunologice către regiunile afectate, amplificând potenţial beneficiile tratamentelor direcţionate.
Legătura cu demenţa vasculară şi comorbidităţile
Pe lângă boala Alzheimer, multe cazuri prezintă componente vasculare (demenţă mixtă). Factorii vasculari — hipertensiunea arterială, ateroscleroza, dislipidemia şi inflamaţia sistemică — pot contribui la scăderea PIP2 prin modificări metabolice ale lipidelor de membrană sau prin activarea enzimelor care hidrolizează PIP2 (de exemplu, fosfolipaza C). Înţelegerea acestor conexiuni va permite abordări terapeutice personalizate, direcţionate nu doar spre creier, ci şi spre condiţiile sistemice care predispun la pierderea homeostaziei lipidice.
Paşii următori: situri de legare, fizica membranei şi dezvoltarea terapiei
Rămân întrebări cheie. Laboratorul Harraz intenţionează să cartografieze exact cum restricţionează PIP2 Piezo1: se leagă PIP2 direct de regiuni proteice specifice ale canalului sau modifică proprietăţile membranei înconjurătoare astfel încât porul canalului să aibă o probabilitate mai mică de deschidere? Răspunsul la aceste detalii va ghida strategiile de dezvoltare a medicamentelor — fie prin molecule care mimează PIP2, agenţi care stimulează producţia locală de PIP2, fie prin inhibitori selectivi de Piezo1 adaptaţi la microvasculatura cerebrală.
Strategiile pot include:
- Compuşi mimetici ai PIP2 sau derivaţi stabilizaţi care nu sunt rapid degradaţi în mediu biologic.
- Producţie locală crescută a PIP2 prin reglarea enzimelor sintetice (kinaze fosfatidilinozitol), eventual prin abordări genetice sau terapii medicamentoase direcţionate.
- Inhibitori specifici Piezo1 cu selectivitate pentru izoformele exprimate în vasele cerebrale sau cu profil farmacocinetic care favorizează acumularea la nivel microvascular.
- Strategii de livrare: nanoparticule liposomale, vehicule care traversează bariera hematoencefalică (BHE), administrare intratecală sau directă în regiuni cerebrale selectate, pentru a limita efectele sistemice.
De asemenea, este esenţial să se investigheze cauzele upstream ale reducerii PIP2: este pierderea rezultatul inflamaţiei cronice, al alterării metabolismului lipidic, al stresului oxidativ sau al activării enzimei fosfolipaza C în contextul îmbătrânirii? Stabilirea acestor legături va extinde opţiunile de intervenţie şi ar putea identifica biomarkeri utili pentru monitorizarea răspunsului la tratament în studiile clinice.
Provocări de siguranţă şi livrare
Transpunerea în terapii umane implică provocări majore. Orice agent care modifică PIP2 sau inhibă Piezo1 trebuie să fie evaluat riguros pentru efectele off-target, deoarece PIP2 reglează numeroase canale şi căi celulare în multe tipuri de ţesuturi. De aceea, ţintirea precisă a microvasculaturii cerebrale, cu evitarea perturbării funcţiilor vitale la nivel sistemic (de exemplu, în inimă sau rinichi), va fi o cerinţă centrală pentru siguranţă clinică.
Proiectarea studiilor clinice va necesita biomarkeri de perfuzie cerebrală (imagistică perfuzională, PET, RMf avansat) şi markeri biochimici ai homeostaziei lipidice, împreună cu teste cognitive standardizate pentru a demonstra beneficiile funcţionale. De asemenea, modelarea farmacocinetică şi toxicologică va ghida dozele şi frecvenţa administrării.

Osama Harraz, Ph.D., profesor asistent de farmacologie la Larner College of Medicine, examinează vasculaţia cerebrală printr-un microscop cu fluorescenţă widefield în laboratorul său de la University of Vermont.
Perspective ale experţilor şi semnificaţie clinică
„Ţintirea interacţiunilor lipid–canal este o frontieră emergentă în medicina neurovasculară,” spune Dr. Maya Singh, neuroscientist neimplicată în studiu. „Dacă înlocuirea PIP2 sau modularea Piezo1 poate fi făcută în siguranţă şi livrată în regiunile cerebrale potrivite, ar putea completa terapiile orientate spre amiloid sau tau prin păstrarea suportului vascular de care neuronii au nevoie.”
Această descoperire reprezintă un pas promiţător, dar incipient. Transpunerea sa în terapii umane va necesita lucrări mecanistice detaliate, teste de siguranţă şi proiectarea atentă a sistemelor de livrare pentru a atinge microvasculatura cerebrală fără efecte sistemice nedorite. Totuşi, prin dezvăluirea unui punct de control molecular tangibil pentru fluxul sanguin, această cercetare deschide o nouă direcţie pentru combaterea contribuţiilor vasculare la demenţă.
Aspecte practice şi recomandări pentru cercetare viitoare
Recomandări pentru paşii următori în cercetare includ:
- Cartografiere structurală a locurilor de interacţiune PIP2–Piezo1 folosind cristalografie, cryo-EM şi mutageneză direcţionată.
- Studii longitudinale în modele animale care să evalueze dacă restabilirea PIP2 previne declinul cognitiv pe termen lung sau doar ameliorează parametrii hemodinamici pe termen scurt.
- Dezvoltarea şi validarea biomarkerilor non-invazivi pentru PIP2 şi pentru activitatea Piezo1 în creier (de ex. semnături metabolomice sau imagistice).
- Evaluări ale interacţiunilor cu terapii existente pentru Alzheimer şi pentru factorii de risc vascular, pentru a determina potenţialele sinergii sau contraindicaţii.
Prin integrarea acestor linii de investigaţie — structurală, mecanistică, preclinicǎ şi de dezvoltare terapeutică — comunitatea ştiinţifică poate transforma o descoperire moleculară fundamentală într-o strategie clinică viabilă pentru protejarea fluxului sanguin cerebral şi reducerea riscului de demenţă vasculară.
Concluzie
Descoperirea rolului PIP2 ca frână moleculară a canalului Piezo1 oferă o perspectivă nouă asupra reglementării microcirculaţiei cerebrale şi sugerează strategii terapeutice inovatoare pentru bolile neurovasculare şi demenţă. Prin combinarea cercetării fundamentale cu dezvoltarea tehnologiilor de livrare şi cu validarea biomarkerilor, există potenţialul de a traduce aceste rezultate în intervenţii care să îmbunătăţească perfuzia cerebrală, să protejeze funcţia neuronală şi, eventual, să atenueze declinul cognitiv asociat cu boala Alzheimer şi cu demenţele vasculare.
Termeni cheie incluşi: flux sanguin cerebral, PIP2, Piezo1, microcirculaţie cerebrală, boala Alzheimer, demenţă vasculară, canale ionice mecanosensibile, fosfolipide, bariera hematoencefalică.
Sursa: scitechdaily

Lasă un Comentariu