10 Minute
Un mic studiu clinic desfășurat în Statele Unite sugerează că două medicamente repurpose — un tratament pentru diabet și un spray cu insulină administrat pe cale intranazală — pot îmbunătăți în siguranță markeri ai sănătății cerebrale la persoanele cu risc pentru boala Alzheimer. Studiul s-a concentrat pe măsuri metabolice și neurovasculare asociate declinului cognitiv timpuriu și a generat semnale încurajatoare care justifică trialuri mai numeroase și pe perioade mai lungi.
De ce cercetătorii au vizat metabolismul și fluxul sanguin cerebral
Boala Alzheimer și demențele asociate sunt condiții biologic complexe; tratamentul lor eficient va necesita probabil strategii complementare și sinergice. În loc să vizeze direct semnele tardive — cum ar fi plăcile mari de amiloid — acest trial a testat intervenții care modifică metabolismul celular, inflamația și circulația cerebrală, procese «upstream» care pot crește reziliența neuronală și pot întârzia apariția leziunilor ireversibile.
Intervențiile au fost empagliflozin, un medicament cunoscut pentru tratamentul diabetului zaharat tip 2 și pentru protecția cardiovasculară (inhibitor SGLT2), și un spray nazal cu insulină conceput pentru a livra insulină direct către creier. Empagliflozin influențează modul în care organismul gestionează glucoza și sodiul, reducând stresul celular și inflamația și îmbunătățind eficiența energetică a țesuturilor. Insulina intranazală urmărește să contracareze rezistența insulinică la nivel cerebral — un factor tot mai implicat în declinul cognitiv — susținând în același timp sănătatea neuronală și funcțiile imune ale sistemului nervos central.
Abordarea este aliniată la modele emergente ale bolii Alzheimer care pun accent pe unitatea neurovasculară, metabolismul energetic și interacțiunea dintre neuroni, celule gliale și vasele de sânge. Modificarea metabolismului cerebral și îmbunătățirea perfuziunii pot reduce acumularea proteică patologică, cum ar fi tau-ul hiperfosforilat, prin scăderea stresului oxidativ, reglarea autofagiei și optimizarea clearence-ului interstițial și al lichidului cerebrospinal.
Designul studiului și cine a participat
Acest trial de fază II, orientat pe siguranță, a înrolat 47 de adulți cu vârste între 55 și 85 de ani; 42 dintre ei au finalizat protocoalele de patru săptămâni. Eșantionul a inclus persoane cu tulburare cognitivă ușoară (MCI) sau demență ușoară, precum și voluntari cognitiv normali care prezentau semne moleculare ale bolii Alzheimer la testele de biomarkeri. Participanții au fost randomizați în patru brațe: empagliflozin singur, spray cu insulină singur, ambele tratamente împreună sau placebo.
Obiectivul primar fiind evaluarea siguranței și tolerabilității pe termen scurt, studiul nu a fost proiectat pentru a demonstra eficacitate definitivă. Cu toate acestea, cercetătorii au colectat un set larg de biomarkeri și rezultate imagistice pentru a detecta tendințe timpurii: analize din lichidul cefalorahidian (LCR/CSF), teste cognitive standardizate, măsurători ale conectivității materiei albe prin imagistică prin rezonanță magnetică (DTI), evaluări ale fluxului sanguin cerebral (perfuzie), și markeri serici de colesterol și inflamație. Aceste endpoint-uri exploratorii sunt utile pentru a identifica semnale biologice coerente care pot ghida proiectarea studiilor ulterioare.
De asemenea, designul factorial (braț cu combinație) a permis investigarea potențialelor efecte aditive sau sinergice între modularea metabolică sistemică și suportul neuroendocrin local. Datele demografice, comorbiditățile și tratamentele concomitente au fost raportate pentru a evalua confounding-ul clinic, iar analiza a inclus ajustări pentru vârstă, sex și stadiul cognitiv la momentul inițierii tratamentului.
Constatări cheie: semnale în tau, cogniție și circulație
Deși diferențele statistice între grupuri nu au atins semnificație dat fiind dimensiunea mică a eșantionului și fereastra scurtă de tratament, au apărut câteva modele notabile. Subiecții tratați doar cu empagliflozin au înregistrat scăderi ale nivelurilor de tau în lichidul cerebrospinal — o proteină ce poate forma încurcături toxice în creierul afectat de Alzheimer — concomitent cu îmbunătățiri ale fluxului sanguin cerebral și modificări favorabile ale unor markeri lipoproteici asociați riscului de demență.
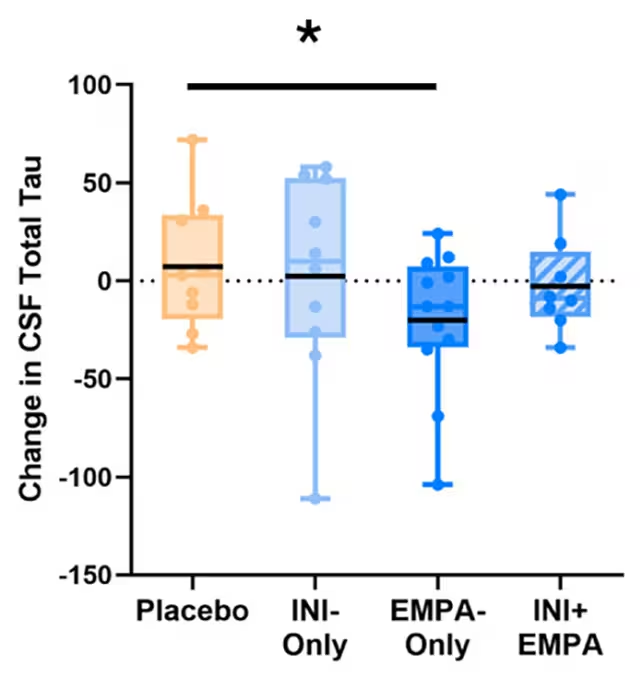
Unul dintre beneficiile observate la pacienții EMPA-Only a fost semnalul de reducere a acumulării de tau în lichidul cefalorahidian (CSF). (Erichsen et al., A&D, 2025)
Participanții care au primit insulina intranazală au obținut scoruri mai bune la testele de memorie și funcție executivă pe parcursul scurt al trialului. Imagistica cerebrală a acestor subiecți a arătat, de asemenea, o conectivitate îmbunătățită a materiei albe și o perfuzie crescută în regiuni implicate în procesarea memoriei, ceea ce se potrivește cu studii anterioare care leagă semnalizarea insulinică de sănătatea neurovasculară și plasticitatea sinaptică.
Observațiile combinate susțin ipoteza conform căreia reducerea inflamației sistemice și optimizarea parametrilor metabolici pot limita progresia patologiei tau, în timp ce suportul direct al metabolismului neuronal prin insulină poate îmbunătăți funcțiile cognitive care depind de eficiența sinaptică și perfuziunea locală. Împreună, cele două intervenții au oferit un profil coerent de biomarkeri care merită investigat în studii mai mari, orientate spre endpoint-uri clinice și funcționale.
Cum ar putea funcționa împreună medicamentele
Modelul propus de autori susține ideea unui efect complementar între modularea metabolică sistemică și susținerea neuroendocrină targetată. Empagliflozin, ca inhibitor SGLT2, reduce glicemia prin creșterea excreției urinare de glucoză și modifică echilibrul sodiu-apă, efecte care pot scădea stresul oxidativ și inflamația sistemică. Reducerea inflamației sistemice are potențialul de a influența microglia și astrocitele la nivel cerebral, diminuând fenotipurile pro-inflamatorii care favorizează acumularea și hiperfosforilarea tau-ului.
Pe de altă parte, insulina administrată intranazal oferă un mijloc de a ridica semnalizarea insulinică în creier fără a produce hipoglicemie sistemică semnificativă. Semnalizarea insulinică eficientă este esențială pentru metabolismul neuronal, plasticitatea sinaptică și reglarea funcțiilor imune locale. Prin restabilirea unei comunicări insulinice mai bune la nivelul neuronilor și al celulelor gliale, se pot observa îmbunătățiri ale memoriei de lucru, ale proceselor executive și ale perfuziei locale prin efecte asupra vaselor mici și ale autorreglării vasculare cerebrale.
Sinergia teoretică dintre cele două strategii constă în capacitatea empagliflozinului de a reduce povara inflamatorie și metabolică periferică, facilitând astfel acțiunea benefică a insulinei intranazale la nivel central. Acest echilibru ar putea stimula răspunsuri imune protectoare (clearance microglial optimizat) fără a declanșa neuroinflamație dăunătoare, un aspect critic în dezvoltarea terapiilor pentru boala Alzheimer.
Securitate și limitări
În acest studiu scurt, nu s-au raportat efecte adverse severe legate de niciuna dintre intervenții, iar tratamentele au fost în general bine tolerate în diferitele categorii de vârstă și subtipuri clinice. Totuși, autorii subliniază limitările clare: dimensiune mică a eșantionului, durata scurtă de expunere (patru săptămâni) și natura exploratorie a numeroaselor endpoint-uri de biomarkeri. Aceste limitări reduc puterea statistică și capacitatea de a trage concluzii ferme privind eficacitatea clinică.
Din perspectiva siguranței, inhibitorii SGLT2 au un profil cunoscut în diabet, incluzând riscuri rare de infecții genitale, deshidratare sau modificări ale funcției renale, care trebuie monitorizate în trialurile la pacienți mai în vârstă cu comorbidități. Pentru insulina intranazală, principalele preocupări sunt iritația nazală locală, riscul ipoglicemiei sistemice la doze mari și variabilitatea administrării intranazale între subiecți. În studiile viitoare, monitorizarea atentă a parametrilor metabolici, renali și a glicemiei va fi esențială.
Mai mult, multiplicitatea analizelor pe biomarkeri introduce provocarea fals-pozitivității; este important ca observațiile semnificative din aceste evaluări exploratorii să fie reproduse în studii independente cu planuri statistice predefinite și endpoint-uri clinice relevante, cum ar fi rata de progresie a declinului cognitiv sau apariția demenței clinic definite.
Următorii pași: extindere și terapie combinată
Cercetătorii planifică să testeze aceste terapii în cohorte mai mari, cu perioade de urmărire semnificativ mai lungi, pentru a cuantifica efectele asupra cogniției, declinului funcțional și biomarkerilor validați ai bolii Alzheimer. Avantajul repurposing-ului — utilizarea unui medicament pentru diabet deja aprobat și a unui dispozitiv de administrare a insulinei cu profil de siguranță replicat — este că, în cazul în care eficacitatea va fi demonstrată, implementarea în practică ar putea fi accelerată comparativ cu molecule complet noi.
Studiile viitoare ar trebui să includă endpoint-uri clinice clare (ex: scoruri MMSE, ADAS-Cog, evaluări ale activităților zilnice), analize longitudinale ale CSF pentru tau și amiloid, imagistică avansată (MRI funcțional, DTI, perfuzie ASL), precum și biomarkeri periferici de inflamație și metaboliți lipidici. De asemenea, este utilă explorarea efectelor diferențiate în subgrupuri definite prin statusul genetic (de ex. APOE ε4), prezența comorbidităților metabolice și stadiul bolii la inițierea terapiei.
În termeni de reglementare, rezultatele pozitive din trialuri mai mari ar putea susține extinderea indicațiilor pentru un medicament aprobat (empagliflozin) și aprobarea unei noi utilizări a insulinăi intranazale pentru intervenții neuroprotectoare. Cost-eficiența terapiei combinate, accesibilitatea și acceptabilitatea pacientului vor fi, de asemenea, factori cheie în era translatională a acestor intervenții.
Perspective de expert
Dr. Maria Alvarez, neurolog și cercetător clinic neimplicat în studiu, a comentat: "Acest trial este un exemplu de cercetare pragmatică, ghidată de mecanisme. Vizarea metabolismului și a sănătății vasculare devreme în cursul bolii are sens fiziologic. Semnalele sunt modeste, dar suficient de consistente pentru a justifica trialuri mai mari care pot testa beneficiul în condiții reale."
Opinia experților subliniază importanța de a combina dovezile biomarkerilor cu rezultate clinice robuste. Valorile adăugate ale acestui tip de cercetare includ identificarea de fenotipuri care răspund la intervenții metabolice, optimizarea dozajelor și a regimurilor de administrare intranazală, precum și explorarea efectelor pe termen lung asupra progresiei tau și a funcției cognitive.
Per ansamblu, concluziile subliniază metabolismul cerebral și sănătatea neurovasculară ca fronturi acționabile în lupta împotriva bolii Alzheimer și deschid calea către terapii combinate care să intervină mai devreme în cascada patologică. Următoarele etape vor determina dacă aceste semnale timpurii se transformă în beneficii clinice semnificative pentru pacienți, ceea ce ar reprezenta un progres important în medicina neurodegenerativă.
Pe lângă dimensiunea clinică, aceste rezultate stimulează direcții de cercetare fundamentale: investigarea mecanismelor moleculare prin care SGLT2 inhibitori influențează inflamarea microglială; rolul insulinorezistenței cerebrale în disfuncția sinaptică; și modul în care perfuzia microvasculară afectează clearance-ul proteinelor patologice. Aprofundarea acestor conexiuni va îmbunătăți capacitatea de a proiecta terapii țintite și biomarkeri predictivi pentru răspunsul terapeutic.
Sursa: sciencealert

Lasă un Comentariu