10 Minute
Cercetătorii de la Institutul de Neuroștiințe (IN), un centru comun al Consiliului Național pentru Cercetare al Spaniei (CSIC) și al Universității Miguel Hernández din Elche (UMH), raportează că organismul folosește două sisteme moleculare distincte pentru detectarea frigului. Pielea se bazează în principal pe canalul ionic TRPM8, în timp ce organele interne, precum plămânii și stomacul, depind mai mult de TRPA1. Această divizare moleculară ajută la explicarea de ce o adiere rece, inhalarea aerului rece sau consumul unei băuturi foarte reci generează senzații atât de diferite la nivel perceptiv și reflex.
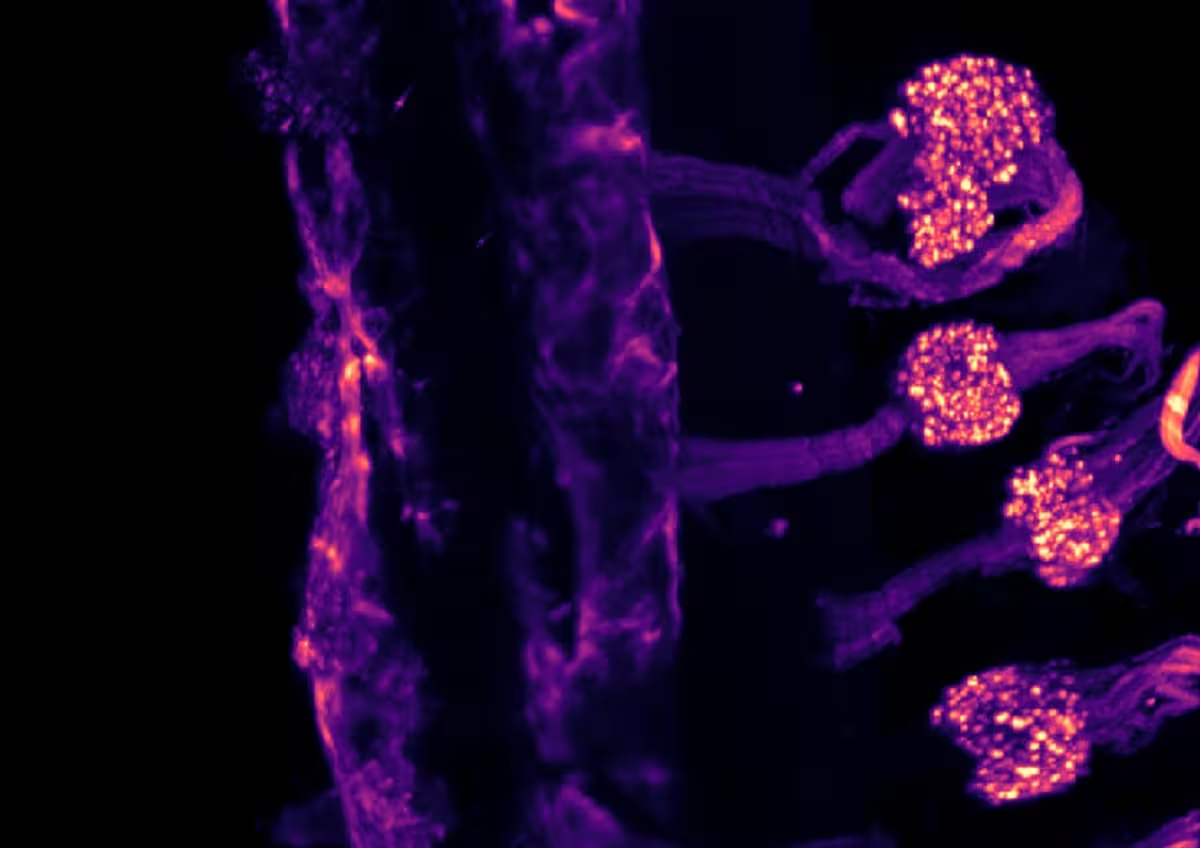
Imagine de microscopie light-sheet care arată expresia canalului ionic TRPM8 în ganglionii senzitivi ai unui șoarece în timpul dezvoltării embrionare, după clarificarea țesutului cu tehnica iDISCO.
Doi senzori, două experiențe ale frigului
Biologia senzorială a tratat mult timp detectarea frigului ca pe o singură cale unitară, însă studiul recent demonstrează că această abordare este prea simplificată. La nivelul pielii, TRPM8 funcționează ca transductor principal pentru frigul ambiental; este rafinat pentru a detecta scăderi moderate de temperatură și pentru a declanșa comportamente protectoare rapide, precum căutarea unei surse de căldură sau tremuratul. În țesuturile viscerale, însă, rezultatele arată că TRPA1 joacă un rol major în semnalizarea frigului, iar acest lucru are implicații funcționale: semnalele generate de un deget înghețat sunt procesate și codificate diferit față de cele generate când aerul rece pătrunde în plămâni sau când o băutură rece atinge esofagul.
Diferențele nu sunt doar teoretice: ele reflectă specializările adaptative ale sistemului nervos. Pe piele, detectarea rapidă a frigului protejează integritatea corporală față de mediu; în interior, semnalizarea termică influențează reglarea internă, precum tiparele respiratorii, reflexele digestive și mecanismele de menținere a homeostaziei.

Eva Quintero, Pablo Hernández-Ortego, Ana Gómez del Campo, Félix Viana și Katharina Gers-Barlag, cercetători IN CSIC-UMH.
Cum a demonstrat echipa existența unor căi separate pentru frig
Investigatorii au combinat imagistica calciului la celule vii și înregistrări electrophiziologice pentru a observa răspunsurile neuronilor senzoriali la răcire. Au comparat neuroni proveniți din ganglionul trigemen, care transmite senzațiile de pe față și suprafața capului, cu neuroni din ganglionii vagali, responsabili pentru inputul senzorial din organele interne. Blocanți farmacologici specifici, capabili să inhibe selectiv TRPM8 sau TRPA1, au fost utilizați pentru a determina ce canale erau responsabile de răspunsurile în fiecare populație neuronală.
Experimente genetice au întărit concluziile. Șoarecii modificați genetic pentru a nu exprima TRPM8 au prezentat răspunsuri diminuate la frig în neuroni asociați cu pielea, în timp ce lipsa TRPA1 a redus sensibilitatea la rece în neuroni conectați la organele interne. Analizele expresiei genice au confirmat că cei doi canali ionici sunt exprimați diferențiat în ganglionii senzoriali, corelând distribuția moleculară cu funcția fiziologică observată.
Metodele folosite includ imagistică de înaltă rezoluție pentru urmărirea fluxurilor de calciu intracelular, care reflectă activitatea neuronală, și înregistrări prin microelectrozi pentru a măsura potențialele de acțiune și proprietățile excitatorii ale fiberelor Aδ și C. În plus, analize transcriptomice și tehnici de hibridizare in situ au oferit date despre ce subpopulații neuronale exprimă TRPM8 sau TRPA1, permițând o mapare detaliată a arhitecturii moleculare a senzatiei termice.
De ce țesuturi diferite au nevoie de detectoare de frig distincte
Forma urmează funcția: pielea trebuie să simtă rapid condițiile externe și să inițieze răspunsuri comportamentale care protejează organismul întreg. TRPM8 este optimizat pentru această sarcină, fiind sensibil la răciri relevante din mediul înconjurător. Pe de altă parte, organele interne au cerințe de reglare diferite: detectarea frigului în căile respiratorii sau în tractul gastrointestinal poate modifica ritmul respirației, motilitatea intestinală și reflexele autonome care mențin echilibrul intern, mai degrabă decât să declanșeze o evadare imediată din mediul rece.
După cum menționează Félix Viana, co-director al laboratorului de Transducție Senzorială și Nocicepție la IN: 'Pielea este echipată cu senzori specifici care ne permit să detectăm frigul ambiental și să ne adaptăm comportamentele defensive.' El adaugă: 'În contrast, detectarea frigului în interiorul corpului pare să se bazeze pe circuite senzoriale și receptori moleculari diferiți, reflectând rolul lor fiziologic mai profund în reglarea internă și în răspunsurile la stimuli externi.'
Aceste diferențe sunt, de asemenea, relevante din perspectiva evolutivă: organismele care trăiesc în medii cu variații extreme de temperatură pot avea adaptări specifice în expresia canalelelor TRP, ceea ce influențează modul în care percep și reacționează la frig.
Implicații pentru medicină și cercetarea fundamentală
Înțelegerea faptului că TRPM8 și TRPA1 servesc roluri specifice în funcție de țesut deschide noi piste pentru tratarea tulburărilor de sensibilitate la frig. Neuropatiile și alte condiții pot genera percepții anormale ale frigului, manifestate ca alodinie la frig dureroasă sau ca o capacitate redusă de a detecta temperaturi periculos de scăzute. Terapia țintită care modulează canalul ionic dominant într-un anumit țesut ar putea diminua efectele secundare și crește eficacitatea tratamentului.
De exemplu, medicamentele sau compușii care antagonizează selectiv TRPA1 în căile viscerale ar putea fi utili în condiții în care frigul din tractul respirator sau gastrointestinal declanșează reflexe patologice, în timp ce modularea TRPM8 la nivelul pielii poate fi o strategie pentru afecțiuni cutanate ce implică hipersensibilitate termică. Cercetările actuale explorează agonisti și antagoniști specifici, precum și terapii bazate pe administrare locală pentru a reduce riscul efectelor sistemice.
Katharina Gers-Barlag, autoarea principală a lucrării, a comentat: 'Descoperirile noastre dezvăluie o imagine mai complexă și nuanțată a modului în care sistemele senzoriale din diferite țesuturi codifică informația termică. Aceasta deschide noi direcții pentru a studia integrarea acestor semnale și modul în care ele pot fi alterate în condiții patologice, cum ar fi anumite neuropatii în care sensibilitatea la frig este perturbată.'
Pe lângă aplicațiile clinice, rezultatele au valoare pentru cercetarea fundamentală: ele permit modelarea mai precisă a traseelor senzoriale, studii comparative între specii și investigarea modului în care canalele TRP contribuie la supraviețuirea în habitate extreme. Conectarea neuroștiinței moleculare cu ecologia și evoluția oferă oportunități pentru înțelegerea adaptărilor la temperaturi scăzute la nivelul întregului organism.
Detalii tehnice și considerații metodologice
Studiul a folosit o abordare multimodală: imagistica calciului în celule vii a permis vizualizarea activității neuronale la scară subcelulară, în timp ce înregistrările electrophiziologice au măsurat proprietățile bioelectrice ale neuronilor individuali. Blocanții farmacologici cunoscuți—utilizați în protocoale experimentale pentru a inhiba TRPM8 sau TRPA1—au fost esențiali pentru a atribui funcționalitatea răspunsurilor la canalele respective. În paralel, modelele transgenice (șoareci KO pentru TRPM8 sau TRPA1) au oferit o validare genetică a rolurilor acestor canale.
Analizele expresiei genice, inclusiv qPCR, secvențierea ARN-ului și metode de hibridizare in situ, au identificat distribuția canalelor în subpopulații specifice de neuroni senzoriali, corelând nivelul de expresie cu sensibilitatea fiziologică. De asemenea, tehnici de clarificare a țesuturilor, cum este iDISCO, combinate cu microscopie light-sheet, au permis o vizualizare tridimensională a expresiei TRPM8 în ganglionii senzoriali în dezvoltare, facilitând maparea spațială a receptorilor în contexte anatomice complexe.
Este important de menționat că interpretarea datelor necesită prudență: condițiile experimentale (temperatura exactă aplicată, viteza de răcire, compoziția soluțiilor, starea de sănătate a animalelor) pot influența răspunsurile observate. Reproducibilitatea în mai multe laboratoare și în contexte diferite este esențială pentru consolidarea concluziilor și pentru traducerea acestor descoperiri în aplicații clinice.
Finanțare, colaborări și perspective evolutive
Acest proiect face parte dintr-un efort internațional mai amplu, finanțat de Human Frontier Science Program și susținut de Planul Național pentru Cercetare Științifică și Dezvoltare Tehnologică și Inovare din Spania, de Programul Severo Ochoa pentru Centre de Excelență și de Guvernul Valencian. Colaborările între grupuri cu expertiză în neuroștiință moleculară, fiziologie senzorială, ecologie și genetică comparativă urmăresc să descopere fundațiile moleculare ale percepției frigului la specii adaptate la medii extreme și să conecteze fenomenele moleculare cu strategiile de supraviețuire ecologică.
Această direcție integrativă promite să îmbunătățească înțelegerea evolutivă a canalelor TRP și să arate cum variațiile în expresia sau funcția acestor canale pot conferi avantaje adaptative în medii reci, uscate sau cu fluctuații abrupte de temperatură.
Expert Insight
Dr. Maria Torres, neurocercetătoare în domeniul senzorial, neimplicată în studiu, explică importanța descoperirii dincolo de biologia de bază: 'Această cercetare lămurește de ce percepția frigului este atât de variabilă. Clinicienii observă frecvent pacienți ale căror tulburări de sensibilitate la frig sunt localizate la nivelul unui singur segment corporal. Dacă luăm în considerare faptul că nervii și canalele diferite codifică frigul pentru țesuturi diferite, devine mai ușor să concepem teste diagnostice și tratamente țintite. Distincția între TRPM8 și TRPA1 reprezintă o piesă importantă din acest puzzle.'
Răspunsul specialistului subliniază utilitatea practică a studierii canalelor ionice: diagnosticul diferențial al hipersensibilității la frig, programe personalizate de reabilitare senzorială sau testarea farmacologică locală pot beneficia de această clarificare moleculară.
Concluzie
Descoperirea că pielea și organele interne utilizează senzori moleculari distincti pentru frig schimbă profund modul în care înțelegem percepția termică și oferă direcții practice pentru tratarea tulburărilor senzoriale. Prin cartografierea distribuției și funcției TRPM8 și TRPA1 în ganglionii senzoriali, cercetătorii au oferit o imagine mai clară a modului în care sistemul nervos înregistrează și răspunde la temperatură. Studiile viitoare vor investiga interacțiunile dintre aceste căi în senzații complexe — de exemplu, când o persoană inspiră aer rece în timp ce atinge o suprafață rece — și vor testa dacă modularea selectivă a acestor canale poate ameliora sensibilitatea patologică la frig.
Pe termen lung, integrarea datelor moleculare cu modele clinice și ecologice ar putea conduce la instrumente diagnostice mai precise și la terapii locale sau sistemice care să vizeze canalele specifice implicate în simptome. Astfel, înțelegerea diferențelor funcționale între TRPM8 și TRPA1 nu este doar o descoperire în neuroștiința de bază, ci și o platformă pentru inovații în medicină, fiziologie comparativă și biologie evolutivă.
Sursa: scitechdaily


Lasă un Comentariu