10 Minute
Anxietatea s-ar putea să nu fie determinată numai de neuroni. Cercetări noi realizate pe șoareci sugerează că un soi de „tragere” între două grupuri distincte de celule imune din creier — microglia — poate comuta comportamentul anxios între activ și inactiv. Această descoperire reorientează modul în care oamenii de știință înțeleg rădăcinile biologice ale anxietății și indică direcții noi, orientate spre sistemul imunitar, pentru tratamente viitoare. Pe lângă implicațiile teoretice, rezultatele au potențial pragmatic: ele deschid posibilitatea identificării unor noi biomarkeri și ținte terapeutice în neuroimunologie și psihiatrie.
Cercetătorii au descoperit că două grupuri concurente de celule imune din creier contribuie la determinarea nivelurilor de anxietate. Echilibrul dintre aceste populații microgliale ar putea explica de ce anxietatea uneori scapă de sub control și se transformă în tulburare cronică. În plus, această idee oferă o explicație biologică pentru variațiile individuale în răspunsul la stres și pentru unele forme de anxietate refractare la tratamentele convenționale pe bază de neurotransmițători.
Immune cells, not just neurons: a surprising place to look
Pentru decenii, cercetarea anxietății s-a concentrat în special pe circuitele neuronale, neurotransmițători și sinapse. Totuși, creierul conține și celule imune rezidente — microglia — care monitorizează și întrețin țesutul neural. Aceste celule elimină sinapse inutile (pruning sinaptic), răspund la leziuni și modelează semnalele inflamatorii locale. Echipa de la University of Utah a constatat că două subpopulații de microglia se comportă ca două comenzi opuse: una acționează ca un „accelerator”, promovând comportamente asemănătoare anxietății, iar cealaltă funcționează ca o „frână”, suprimând aceste răspunsuri. Această metaforă evidențiază modul în care interacțiunile imun-neuronale pot regla tonusul emoțional și comportamental în funcție de contextul de mediu și de semnalele interne ale organismului.
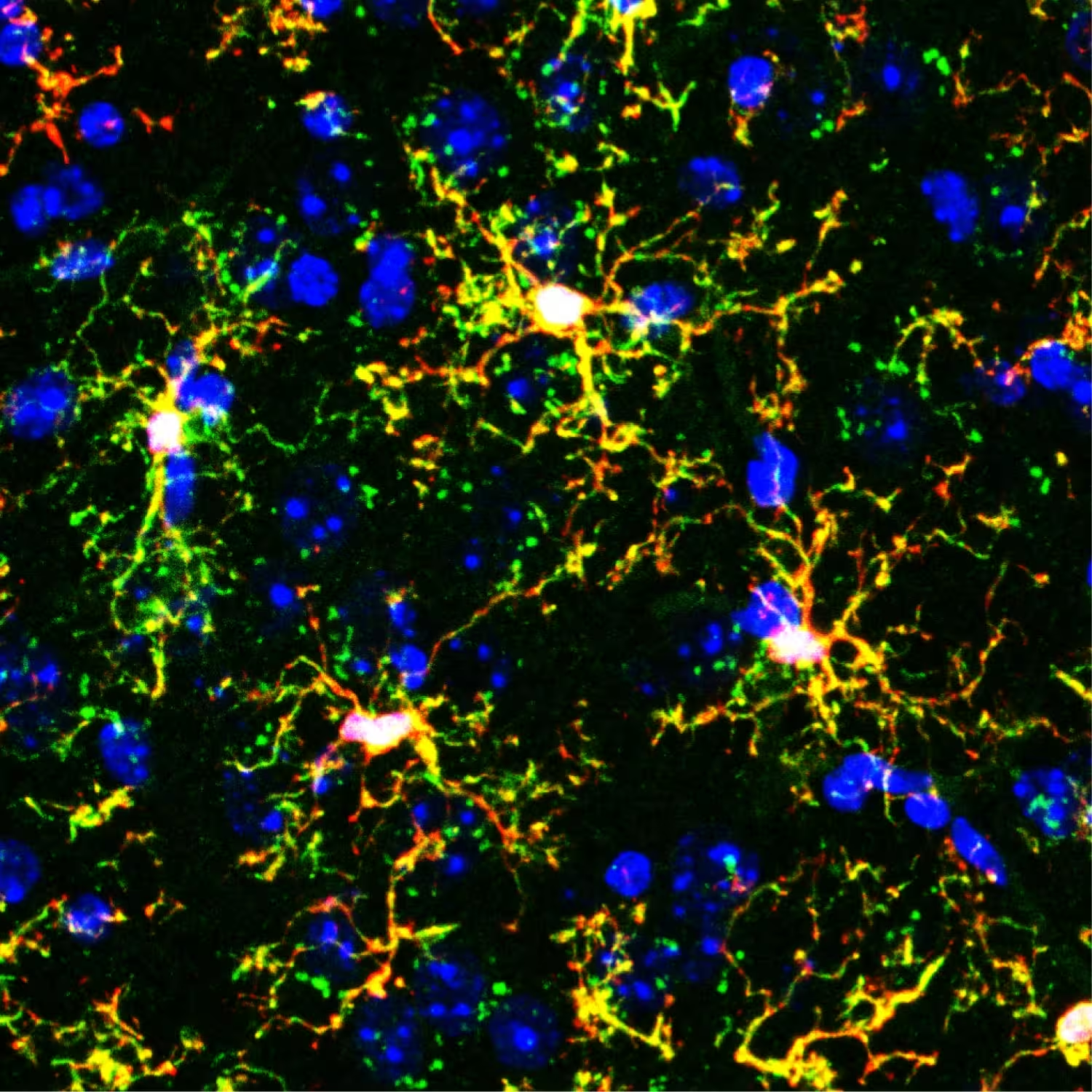
Imagine la microscop fluorescent a microgliei transplantate (formații ramificate galbene) într-un creier de șoarece. Roșul marchează microglia editată genetic transplantată, verdele marchează celule imune numite macrofage, iar albastrul marchează nucleele celulare.
How the researchers untangled the microglial tug-of-war
Studiul, publicat în revista Molecular Psychiatry, a pornit de la o observație tulburătoare. Când cercetătorii au perturbat selectiv o subgrupă de microglia cunoscută ca microglia Hoxb8, șoarecii au dezvoltat comportamente asociate anxietății: curățare excesivă (grooming) și evitarea spațiilor deschise. Cu toate acestea, când toate microgliile au fost suprimare simultan — incluzând atât Hoxb8, cât și cele non-Hoxb8 — animalele au prezentat comportament aparent normal. Această contradicție a sugerat că cele două populații ar putea avea roluri opuse, iar eliminarea ambelor a restabilit un echilibru comportamental aparent normal, dar printr-un mecanism diferit.
Pentru a testa această ipoteză, investigatorii au recurs la o strategie experimentală îndrăzneață: au creat șoareci lipsiți complet de microglia, folosind tehnologii genetice și chimice pentru a depleta populațiile rezidente, apoi au transplantat înapoi populații microgliale specifice pentru a observa cum fiecare influențează comportamentul. Această abordare de „pierdere și refacere” permite disecarea contribuției fiecărei subpopulații la fenotipul anxios și furnizează informații despre interacțiunile specifice între microglie și circuitele neuronale care reglează frica, explorarea și vigilența.
Accelerators and brakes, isolated
Când șoarecii au primit doar microglia non-Hoxb8, au dezvăluit semne clare de anxietate crescută — echivalentul comportamental al „apăsării pedalei de accelerație”. Curățarea excesivă și aversiunea față de zonele deschise s-au accentuat, precum și alte manifestări comportamentale de hipervigilență. În schimb, șoarecii care au primit doar microglia Hoxb8 au rămas relativ calmi și adaptați, ceea ce sugerează o influență inhibitorie dominantă a acestei subpopulații. Foarte important, când ambele populații au fost restaurate în același animal, comportamentul s-a echilibrat: frâna a contracarat acceleratorul, prevenind apariția unor răspunsuri anxioase cronice.
Aceste rezultate au condus autorul principal, Mario Capecchi, PhD, la concluzia că cele două populații microgliale setează nivelul potrivit de anxietate în funcție de condițiile de mediu. „Împreună, ele reglează gradele potrivite de anxietate în răspuns la ceea ce se întâmplă în mediul șoarecelui,” a explicat Capecchi. În termeni științifici, acesta este un exemplu de reglementare homeostatică multi-cellulară, în care diverși effectori imunologici contribuie la stabilitatea răspunsurilor comportamentale adaptative.

Donn Van Deren, PhD, autor principal al studiului
Why this changes how we think about anxiety biology
Marea majoritate a medicamentelor psihiatrice vizează căi de semnalizare neuronală — receptori, transporteri de neurotransmițători sau module ale sinapselor. Noile constatări sugerează că celulele imune din creier nu sunt observatori pasivi, ci actori activi în reglarea comportamentului. Dacă subtipuri microgliale și circuite similare există la om — iar echipa menționează că oamenii par să aibă o diversitate microglială comparabilă — atunci anumite forme de anxietate ar putea fi cauzate de dezechilibre între aceste populații imune, mai degrabă decât de defecte clasice ale neurotransmițătorilor. Aceasta nu înseamnă că microglia înlocuiește neuronii ca actori centrali în reglarea dispoziției, dar adaugă o nouă dimensiune: interacțiunile imun-neuronale care ajustează răspunsurile comportamentale.
Mai mult, modelul accelerator–frână oferă un mecanism plauzibil pentru schimbări bruște în starea anxioasă la unii indivizi: pierderea microgliei cu rol inhibitor (frâna) sau hiperactivarea populației cu rol pro-anxios (acceleratorul) ar putea declanșa un salt către vigilență persistentă și comportamente de evitare. Aceasta are implicații pentru înțelegerea vulnerabilității la tulburările de anxietate, pentru prognostic și pentru modul în care factorii de mediu (infecții, inflamație sistemică, traumă) pot influența direct starea emoțională prin alterarea populațiilor microgliale.
Potential paths for therapies and diagnostics
Transpunerea acestor descoperiri în tratamente umane va necesita timp considerabil și validare riguroasă. Totuși, implicațiile conceptuale sunt majore. Intervențiile terapeutice ar putea urmări consolidarea microgliei cu efect inhibitor, suprimarea microgliei cu efect pro-anxios sau recalibrarea semnalizării dintre aceste subtipuri. Abordările posibile includ mici molecule care modifică funcția microglială, imunoterapii țintite, sau strategii pe bază de celule în viitorul îndepărtat. De asemenea, ar putea apărea teste diagnostice care evaluează starea microglială din probe periferice sau prin imagistică avansată pentru a identifica pacienții cu dezechilibrul accelerator–frână.
„Suntem departe de partea terapeutică,” a spus Donn Van Deren. „Dar în viitor, probabil că se vor putea viza populații foarte specifice de celule imune din creier și se vor corecta prin abordări farmacologice sau imunoterapeutice. Aceasta ar reprezenta o schimbare majoră în modul de tratare a tulburărilor neuropsihiatrice.” În continuare, trebuie subliniat că siguranța, specificitatea și capacitatea de a traversa bariera hematoencefalică sunt provocări tehnologice semnificative pentru orice terapie vizând microglia la om.
Scientific context and open questions
- Mecanismele prin care microglia Hoxb8 și non-Hoxb8 exercită efecte opuse rămân de clarificat: secretă ele molecule de semnalizare diferite (citokine, chimiokine, factori neurotrofici), prunează sinapse distincte sau se conectează la circuite neuronale diferite? Identificarea semnalelor moleculare (de ex. complement, CX3CL1–CX3CR1, TREM2-associate pathways) implicate ar putea oferi ținte terapeutice.
- Cum influențează factorii de mediu și cei de dezvoltare echilibrul dintre aceste populații microgliale? Expunerea la stres în perioada perinatală, infecții sau nutriția maternă pot recalibra proporțiile sau starea funcțională a microgliei, afectând susceptibilitatea la anxietate mai târziu în viață.
- Pot evenimentele imune periferice (infecție, inflamație cronică) reconfigura balanța accelerator–frână a microgliei și astfel pot declanșa sau agrava anxietatea? Există dovezi cumulatoare în literatură că inflamația sistemică influențează comportamentul și funcția microglială, dar legături cauzale directe pentru subtipuri specifice rămân de stabilit.
Răspunsul la aceste întrebări va necesita profilare moleculară detaliată (de exemplu, single-cell RNA-seq pentru a defini semnături transcriptomice ale fiecărei subpopulații), cartografiere de circuite (circuit mapping) pentru a identifica conexiunile neuronale țintite de fiecare tip de microglie, studii pe țesut uman pentru a confirma paralele între specii și modele longitudinale care urmăresc dinamica acestor populații în timpul dezvoltării și după expuneri la stres sau inflamație.
Expert Insight
„Acest studiu redefinesc anxietatea ca o proprietate emergentă a dialogului neural și imun, nu doar ca un defect neuronal izolat,” spune Dr. Laura Mendes, o neuroimunologă și comunicatoare științifică (personaj ficțional). „Dacă vom putea cartografia ce sinapse este vizate de fiecare subtip de microglie și cum modulizează aceste celule sistemele de neurotransmițători, am putea concepe intervenții foarte specifice care refac echilibrul cu efecte secundare reduse față de medicamentele cu acțiune largă.” Această perspectivă subliniază potențialul de a dezvolta terapii personalizate bazate pe profiluri moleculare și pe starea imună a creierului, în loc să se aplice aceeași clasă de medicamente tuturor pacienților cu anxietate.
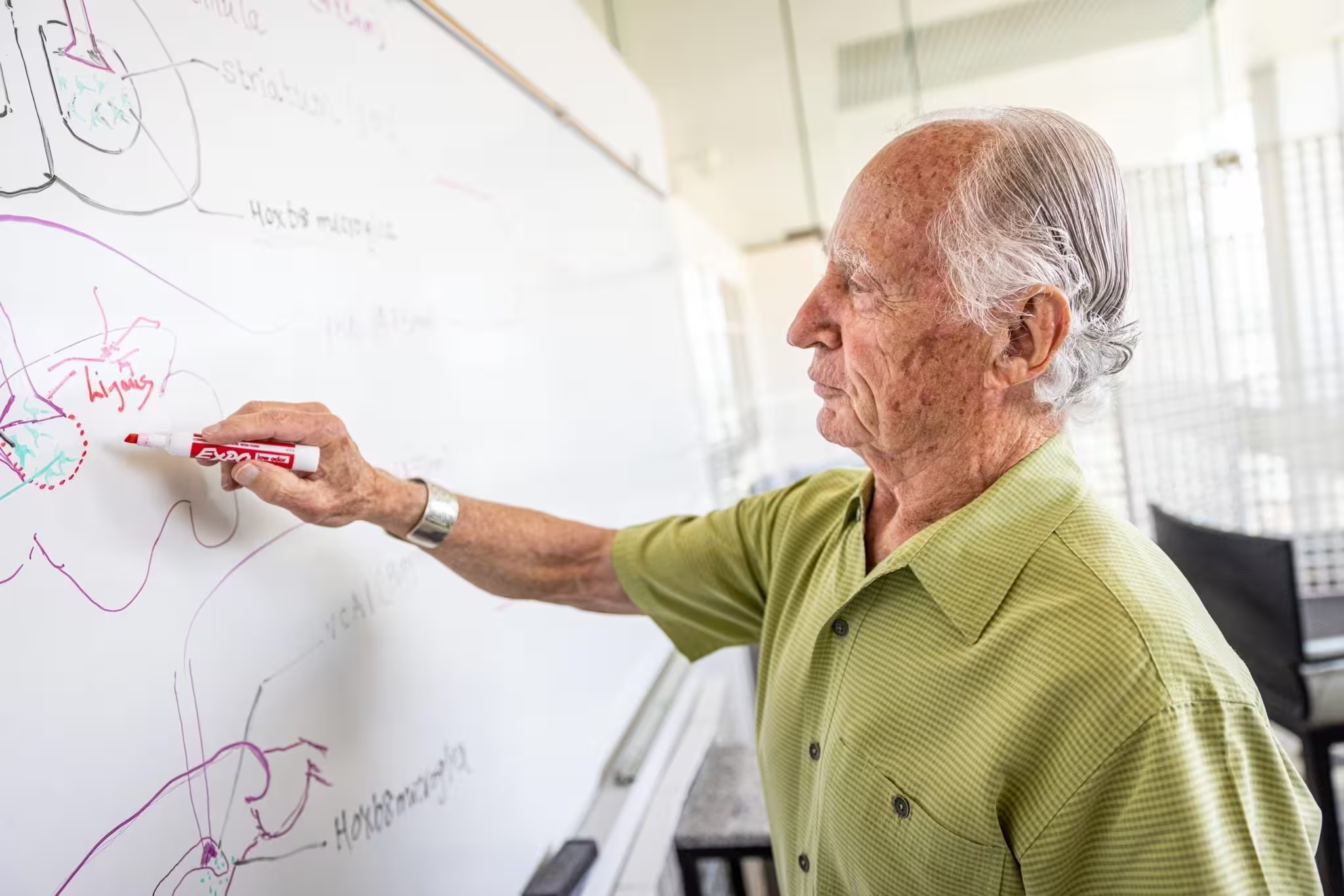
Mario Capecchi, PhD, autor principal al studiului, adnotând un panou alb cu diagrame despre microglia din creier.
What this means for patients and researchers
Pentru persoanele care trăiesc cu tulburări de anxietate, aceste descoperiri reprezintă un pas timpuriu, dar plin de speranță. Ele sugerează existența unor biomarkeri noi și a unor ținte terapeutice dincolo de cadrul tradițional al neurotransmițătorilor, ceea ce ar putea duce la tratamente mai eficiente sau complementare. Pentru cercetători, studiul deschide o direcție promițătoare la intersecția dintre imunologie, genetică și neuroștiințele comportamentale, oferind paradigme experimentale noi pentru a testa ipoteze despre cauze și mecanisme.
Pe măsură ce domeniul avansează, combinarea instrumentelor genetice (modele condiționale, editare genetică), profilării unicelulare, imagisticii avansate și testelor comportamentale va fi esențială pentru a transforma acest avans conceptual în diagnostice sau terapii practice. Până atunci, descoperirea rămâne un memento că sistemul imunitar al creierului joacă un rol dinamic și uneori determinant în modelarea felului în care simțim și reacționăm la lume, prin intermediul interacțiunii complexe dintre microglie, neuroni și semnalele de mediu.
Sursa: scitechdaily

Lasă un Comentariu