11 Minute
Noi cercetări efectuate pe un model de șoarece pentru boala Alzheimer sugerează că factori circulanți în sânge pot accelera sau încetini procesele patologice. Sângele provenit de la animale în vârstă a agravat acumularea de amiloid și comportamentul cognitiv, în timp ce plasma de la donatori tineri a avut efecte protectoare — descoperire care replasează modul în care înțelegem conexiunea sânge-creier în neurodegenerare și deschide componente noi pentru diagnostic și terapie.
Rezumat și context
Cum a testat experimentul efectele vârstei în sânge
Cercetătorii au folosit șoarecii transgenici Tg2576, un model bine stabilit pentru patologia amiloidă asociată bolii Alzheimer, pentru a investiga dacă semnalele sistemice prezente în sânge influențează boala la nivel cerebral. Începând de la aproximativ patru luni de viață, șoarecii Tg2576 receptori au primit transfuzii săptămânale timp de aproximativ 30 de săptămâni. Sângele donator a provenit fie de la șoareci wild-type tineri cu vârste între 50–75 de zile, fie de la șoareci wild-type bătrâni cu vârste între 443–532 de zile.
Protocolul experimental a fost conceput pentru a testa impactul expunerii cronice la factorii circulanți ai unei determinări biologice a ”tinereții” versus ”îmbătrânirii”. Administrarea frecventă a transfuziei a permis evaluarea efectelor cumulative asupra acumulării de amiloid, a funcției sinaptice și a comportamentului spațial. După perioada de tratament, animalele au fost evaluate pentru memorie spațială și ulterior sacrificate pentru analize postmortem detaliate, inclusiv analize imunopatologice, biochimice și proteomice ale țesutului cerebral.
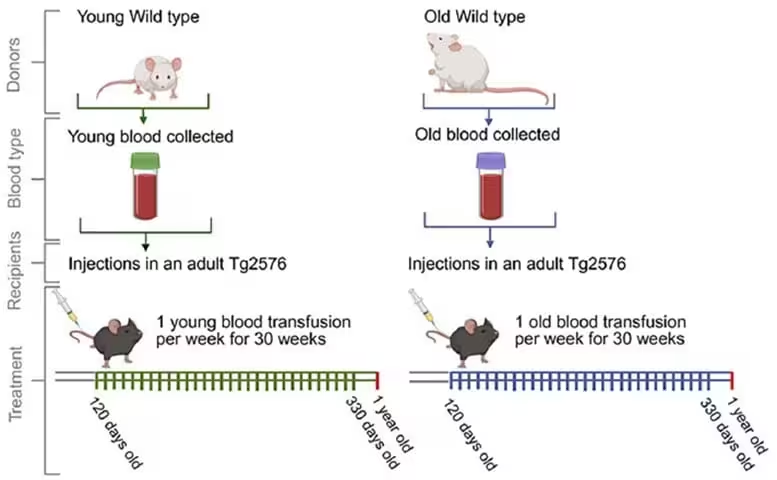
Reprezentare schematică a regimului de transfuzie sanguină (sânge de la șoareci wild type bătrâni și tineri către șoareci Tg2576). Șoarecii wild-type tineri, cu vârste între 50–75 de zile (WT Young), și șoarecii wild-type bătrâni, cu vârste între 443–532 de zile (WT Old), au servit drept donatori de sânge. Acest sânge a fost transfuzat către șoareci Tg2576 de 120 de zile, care au primit transfuzii săptămânale și au fost sacrificați la vârsta de 363–366 de zile. Înainte de sacrificare, șoarecii au fost evaluați pentru memorie spațială. Analizele postmortem au inclus evaluări imunopatologice, biochimice și proteomice ale țesutului cerebral.
Design experimental și metode
Detalii practice ale transfuziei și evaluărilor comportamentale
Tratamentul a fost administrat prin transfuzie sistemică repetată, urmărindu-se să se mențină o expunere continuă la mediul plasmatic al donatorilor. Dimensiunea eșantionului, randomizarea și controlul variabilelor (de exemplu, sexul animalelor, condițiile de îngrijire, dieta) sunt factori esențiali care asigură robustețea rezultatelor în studii pe animale. Evaluarea comportamentală a folosit testul Barnes maze pentru a măsura memoria spațială — un instrument standard în cercetarea cognitivă la modele murine, sensibil la schimbări ale funcției hipocampale și corticale.
Pe lângă teste comportamentale, cercetătorii au aplicat tehnici histologice pentru detectarea plăcilor de beta-amiloid (Aβ) și au realizat teste biochimice pentru cuantificarea fracțiunilor solubile și insolubile de Aβ. Abordarea combinată — comportament, histologie și biochimie — a permis corelarea fenotipurilor funcționale cu sarcina patologică și, în cele din urmă, cu semnăturile moleculare obținute prin proteomică.
Rezultate și analiză moleculară
Măsurători cheie: memorie, plăci și proteine
Testarea comportamentală (Barnes maze) a măsurat capacitatea de orientare spațială, în timp ce colorările histologice și testele biochimice au cuantificat acumularea plăcilor de beta-amiloid (Aβ) în creier. În paralel, echipele au realizat o analiză proteomică amplă pe țesut cerebral pentru a detecta modificări moleculare asociate tratamentelor. Această abordare integrată a permis investigarea legăturii dintre rezultatele comportamentale, povara patologică și schimbările moleculare subiacente.
Remarcabil, șoarecii care au primit sânge de la donatori bătrâni au prezentat o depunere mai rapidă de amiloid și performanțe cognitive mai proaste comparativ cu cei transfuzați cu sânge de la donatori tineri. Profilarea proteomică a identificat peste 250 de proteine diferențial exprimate între grupuri, punând în evidență căi moleculare implicate în funcția sinaptică, semnalizarea endocannabinoidă și reglarea canalelor de calciu. Aceste semnături moleculare oferă mecanisme plauzibile prin care factorii periferici pot reconfigura vulnerabilitatea sistemului nervos central.
Analizele proteomice au folosit instrumentație de înaltă rezoluție (de exemplu, spectrometrie de masă LC-MS/MS cu cuantificare label-free sau pe bază de izotopi), workflow-uri bioinformatice riguroase și validări secundare prin tehnici țintite (de exemplu, western blot, ELISA sau imunohistochimie). Echipa a descris provocările tehnice specifice lucrului cu plasmă și cu matricele cerebrale complexe — componentele sanguine sunt adesea în abundență și pot masca proteine de interes cu expresie mai scăzută, iar matricea cerebrală necesită prelucrări speciale pentru a păstra integritatea proteinelor țintă.
Din lista de proteine diferențiale, au fost evidențiate mai multe clase funcționale: proteine implicate în transmiterea sinaptică (receptori și proteine asociate structurii sinaptice), factori de semnalizare inflamatorie (citokine și chemokine), proteine implicate în homeostazia calciului (canale și proteine reglatoare), și proteine metabolice sau legate de transportul lipidic. Aceste grupuri sugerează mecanisme combinate: inflamație periferică care alterează microambientul cerebral, modificări ale semnalizării sinaptice și perturbări ale echilibrului calciului care pot favoriza agregarea Aβ și declinul funcțional.
Importanța axei sânge-creier în Alzheimer
De ce conexiunea sânge-creier contează pentru boala Alzheimer
Boala Alzheimer este clasic asociată cu acumularea plăcilor de beta-amiloid și cu neurodegenerarea ulterioară. În timp ce Aβ este produs în creier, acest studiu și altele sugerează că sistemul circulator poate transporta modulatori care fie promovează, fie inhibă cascade patologice. Dacă factorii din sânge modifică semnalizarea sinaptică sau gestionarea calciului, ei pot accelera indirect toxicitatea asociată plăcilor și declinul cognitiv.
Investigatorii principali au subliniat că semnalele sistemice din sângele îmbătrânit par să altereze mediul cerebral în moduri care favorizează progresia bolii. Aceasta extinde potențialele ținte terapeutice dincolo de sistemul nervos central, pentru a include molecule derivate din sânge și chiar bariera hemato-encefalică. Cu alte cuvinte, modificarea compoziției factorilor circulanți ar putea fi o strategie pentru a întârzia sau reduce neurodegenerarea.
Literatura anterioară — inclusiv studii de parabioză și experimentări cu plasmă tânără — a sugerat câteva molecule candidate care pot mediatiza efectele benefice (de exemplu, factorii de creștere sau inhibitori ai proteazelor precum TIMP2, discutați în studii separate), dar reproducerea și validarea acestor semnale rămân provocări majore. În același timp, factori pro-inflamatori, componente modificate ale sistemului complement sau proteine malpliate pot acționa ca agenți patogeni transitori sau cronici care sporesc vulnerabilitatea neuronală.
MELISA Institute a contribuit cu analize proteomice extinse la proiect. Echipa a remarcat provocările tehnice de a lucra cu plasmă și cu matrice cerebrale complexe; instrumentația de înaltă rezoluție a permis generarea unor seturi de date robuste care au ajutat la identificarea proteinelor candidate și a căilor implicate în aceste efecte. Colaborări interdisciplinare între neurobiologi, imunologi, proteomiciști și bioinformaticieni au fost esențiale pentru interpretarea rezultatelor și pentru prioritizarea țintelor potențiale pentru studii ulterioare.
Implicatii clinice și cercetare translatională
Implicatii și pași următori pentru translație
Descoperirile întăresc ideea că schimbările legate de vârstă în compoziția sângelui nu sunt doar markeri ai îmbătrânirii, ci modulatori activi ai sănătății cerebrale. Identificarea moleculelor specifice responsabile — citokine inflamatorii, mediatori lipidici alterați, proteine malpliate sau alți peptizi circulanți — reprezintă următorul pas critic. Odată validate, acești factori ar putea deveni ținte pentru diagnostice bazate pe sânge, intervenții preventive sau terapii care restabilesc un mediu sistemic mai „tânăr”.
Mai multe abordări terapeutice pot deriva din aceste rezultate: fractionarea plasmei pentru a extrage componente proteice sau non-proteice benefice; neutralizarea factorilor sanguini patogeni cu anticorpi sau inhibitori; administrarea de proteine tinere identificate ca protectoare; modularea permeabilității barierei hemato-encefalice; sau terapii metabolice și antiinflamatorii care să reducă impactul periferic asupra creierului. Toate aceste strategii vor necesita evaluări preclinice riguroase și studii de fezabilitate înainte de a fi considerate pentru studii clinice la om.
Totuși, cercetătorii avertizează că rezultatele din modele murine nu se traduc direct la oameni. Trialurile umane ar necesita o evaluare atentă a siguranței, identificarea precisă a cauzelor moleculare sau a agenților protectori și considerarea efectelor secundare pe termen lung. În plus, diversitatea genetică, comorbiditățile, medicamentele concomitente și stilurile de viață ale pacienților umani complică translația directă a intervențiilor observate la șoareci.
Direcțiile deschise de studiu includ dezvoltarea biomarkerilor din sânge pentru predicția riscului și monitorizarea cursului bolii, testarea strategiilor de fractionare plasma și a terapiilor bazate pe neutralizarea factorilor patogeni, și consolidarea datelor din studii longitudinale umane care să coreleze semnăturile proteomice circulante cu progresia clinică a bolii Alzheimer. Colaborările între centre de cercetare, industrie și instituții clinice vor fi cruciale pentru a accelera aceste pași translationali.
Limitări, considerații și perspective tehnice
Provocări metodologice și limitări interpretative
Există limitări importante de menționat. Modelele animale oferă control experimental și posibilitatea de a testa mecanisme, dar nu reproduc întotdeauna complexitatea bolii la om. De exemplu, timpul de evoluție, interacțiunile cu boli asociate (diabet, hipertensiune), și diferențele în bariera hemato-encefalică pot influența rezultatele. Mai mult, tehnicile proteomice generează liste mari de candidați — identificarea cauzalității necesită studii funcționale ulterioare (knockout/knockdown, administrare exogenă a proteinei, neutralizare cu anticorpi etc.).
Tecnologiile necesare pentru validare includ proteomica țintită (MRM/PRM), imunotestele de înaltă sensibilitate, studii fenotipice detaliate și cohortele longitudinale umane cu probe plasmatice și evaluări cognitive. În plus, abordări complementare precum analiza exosomilor, metabolomica și studiile de transcriptomică pe celule limitate (single-cell) pot completa harta moleculară a modului în care sângele influențează creierul.
Perspectiva expertului
Comentariu de expert
"Această lucrare leagă în mod convingător îmbătrânirea sistemică de mecanisme centrale ale bolii", spune dr. Laura Mendes, neuroscientist specializată în neuroimunologie. "Avem acum indicii moleculare care explică modul în care periferia modelează reziliența sinaptică și dinamica amiloidului. Provocarea translatională este să trecem de la semnături proteomice complexe la un set tratabil de ținte pe care le putem modula în siguranță la oameni."
Dr. Mendes adaugă că tehnologii precum proteomica țintită, imunotestele de înaltă sensibilitate și studiile longitudinale pe cohorte umane vor fi esențiale pentru a determina dacă semnăturile circulante similare pot prezice progresia Alzheimer la oameni. Ea recomandă, de asemenea, integrarea datelor biologice cu informații clinice și imagistice pentru o translație mai rapidă a rezultatelor preclinice.
Concluzie
Concluzii și perspective viitoare
Acest studiu întărește o perspectivă în creștere: boala Alzheimer nu este doar o problemă restrânsă la creier, ci una care implică întregul organism, în care factorii circulanți pot înclina balanța între reziliență și declin. Cartografierea proteinelor și a căilor modificate de sângele bătrân versus cel tânăr a reprezentat un pas important spre diagnostice noi și intervenții care acționează prin axa sânge-creier. Drumul către terapii umane va fi lung, dar datele oferă puncte moleculare concrete pentru cercetări viitoare.
Pentru viitor, este esențială validarea funcțională a proteinelor candidate, stabilirea mecanismelor cauzale și explorarea strategiilor terapeutice sigure. Colaborarea interdisciplinară, standardizarea protocoalelor proteomice și includerea cohortelor umane bine caracterizate vor accelera transformarea acestor descoperiri preclinice în aplicații clinice, inclusiv biomarkeri de diagnostic bazate pe sânge, intervenții preventive și terapii care vizează atât periferia, cât și creierul.
Sursa: scitechdaily

Lasă un Comentariu