9 Minute
Un studiu internațional recent a identificat o legătură genetică rară, dar puternică, între modificări ale unei singure gene, GRIN2A, și tulburări psihiatrice de debut precoce, precum schizofrenia infantilă. Această descoperire contestă opinia frecventă conform căreia majoritatea bolilor mentale apar doar din interacțiunea multor factori genetici și deschide noi posibilități pentru diagnostic și tratamente țintite.
O legătură surprinzătoare cu o singură genă în boala psihiatrică
Cauzele genetice ale bolilor mentale sunt în general complexe și poligenice, ceea ce înseamnă că sute sau mii de variante contribuie cu efecte mici. Totuși, cercetătorii care au lucrat pornind de la cel mai mare registru mondial dedicat GRIN2A raportează ceva diferit: la unele persoane, o singură variantă a genei GRIN2A pare suficientă pentru a genera simptome psihiatrice, care apar frecvent în copilărie sau adolescență, nu doar la vârsta adultă.
Ce a descoperit echipa
Folosind date dintr-un lot internațional agregat, investigatori au examinat 121 de persoane purtătoare ale unor variante GRIN2A considerate probabil patogene. Dintre acestea, 25 aveau un diagnostic de tulburare mentală — incluzând tulburări de dispoziție, anxietate, tulburări psihotice, de personalitate și tulburări alimentare. Remarcabil este faptul că toți, cu excepția a doi dintre cei 25, prezentau așa-numitele variante "null" ale GRIN2A, care fac ca gena să fie nefuncțională.

Dintre 121 de persoane cu variante GRIN2A probabil cauzatoare de boală, 25 aveau un diagnostic de tulburare mentală.
Coautorul principal, Johannes Lemke de la Universitatea din Leipzig, a subliniat intensitatea semnalului: "Rezultatele noastre curente indică faptul că GRIN2A este prima genă cunoscută care, singură, poate provoca o boală mentală." Studiul a fost publicat în revista Molecular Psychiatry.
Cum afectează GRIN2A creierul
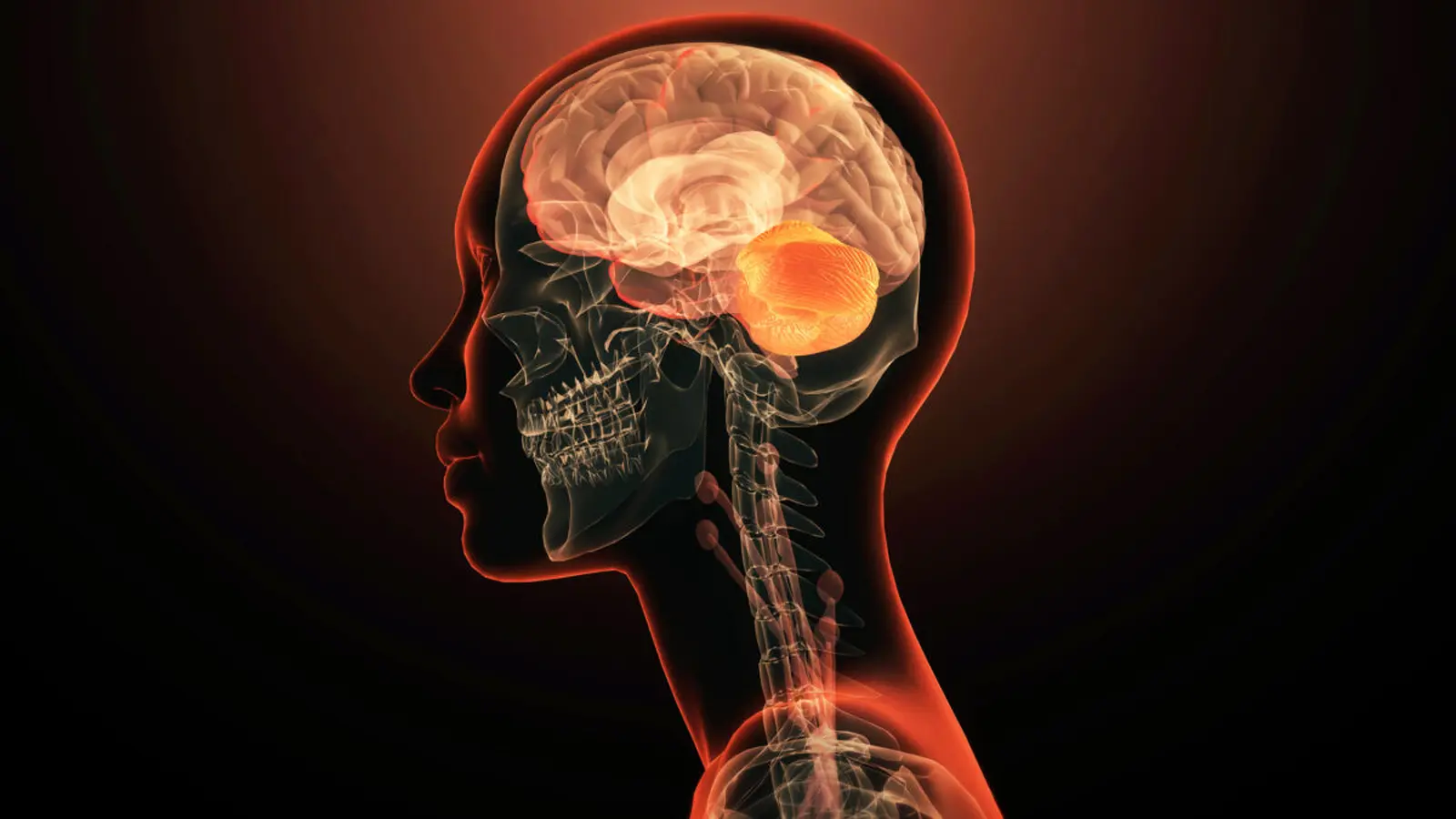
GRIN2A codifică o subunitate a receptorului de tip NMDA pentru glutamat, un complex proteic care mediază semnalizarea excitatorie în creier. Funcția corectă a receptorilor pentru glutamat este esențială pentru cogniție normală, dezvoltarea neuronală și reglarea activității electrice cerebrale. Perturbarea acestor receptori a fost asociată anterior cu epilepsia și schizofrenia.
Majoritatea studiilor anterioare asupra GRIN2A s-au concentrat pe afecțiuni neurodezvoltamentale, precum epilepsia și deficitul intelectual. Această analiză recentă arată că unii pacienți cu modificări ale GRIN2A se prezintă predominant cu simptome psihiatrice — halucinații, paranoia, dereglări ale dispoziției sau tulburări de comportament — și pot să nu aibă deficite neurodezvoltamentale evidente. Aceasta sugerează că GRIN2A poate, în anumite cazuri, să determine tulburări de sănătate mintală izolate, care debutează timpuriu în viață.
Din punct de vedere molecular, subunitățile produse de GRIN2A influențează proprietățile fiziologice ale receptorului NMDA, inclusiv conductanța ionilor, kinetica de deschidere/închidere și modularea de către neurotransmițători sau co-agonisti. Variantele care reduc expresia sau funcția proteinei pot duce la hipofuncție NMDA, o stare care a fost propusă în teoria patogenetică a schizofreniei și a unor tipuri de epilepsie.
Pe plan clinic, heterogenitatea fenotipurilor observate la purtătorii de variante GRIN2A indică faptul că efectul mutațiilor depinde de tipul variantei (loss-of-function versus variante cu efecte parțial dominante negative), de moștenirea genetică, de mediul înconjurător și de interacțiunile cu alte gene implicate în sinapsă și plasticitate neuronală. Această complexitate subliniază necesitatea unei evaluări genetice și neuropsihiatrice detaliate pentru fiecare caz în parte.
Indicații pentru tratament și implicații clinice
Dincolo de diagnostic, studiul oferă indicii terapeutice timpurii. Patru participanți au primit anterior L-serină, un aminoacid care poate potența activitatea receptorului NMDA prin creșterea disponibilității co-agonistului D-serină sau prin alte mecanisme de modulare sinaptică. Toți patru au raportat ameliorări ale simptomelor: unul a încetat să mai aibă halucinații, altul a înregistrat îmbunătățiri comportamentale, iar doi au prezentat remisiune a simptomelor paranoide și reducere a frecvenței crizelor convulsive.
Aceste răspunsuri anecdotice la tratament nu demonstrează eficacitate definitivă, dar sugerează o direcție promițătoare pentru medicina de precizie: identificarea unei variante cauzatoare ar putea ghida terapii țintite menite să restabilească funcția receptorului sau să compenseze efectele ulterioare în circuitele neuronale.
În practică, opțiunile terapeutice pot include intervenții farmacologice orientate către receptorii glutamatergici (modulatori NMDA, co-agonisti), suplimente metabolice precum L-serină sau D-serină în protocoale controlate, precum și strategii non-farmacologice de susținere: terapie cognitiv-comportamentală adaptată, managementul epilepsiei, și măsuri integrative de reabilitare cognitivă. Totuși, fiecare intervenție trebuie evaluată riguros într-un cadru clinic controlat înainte de a fi recomandată pe scară largă.
Importanța recunoașterii unui substrat genetic este dublă: pe de o parte poate oferi explicații etiologice pentru simptomele severe precoce și, pe de altă parte, poate preveni tratamente empirice ineficiente sau potențial dăunătoare. De exemplu, în anumite mutații GRIN2A, stimularea excesivă a NMDA poate fi contraindicată, în funcție de efectul variantei asupra receptorului; de aceea, testarea funcțională în laborator este un pas critic înainte de implementarea unor intervenții direcționate.
De ce schimbă aceasta modul în care gândim genetica psihiatriei
Modelul dominant în genetica psihiatriei pune accent pe numeroase variante cu risc mic care interacționează între ele și cu factorii de mediu. Descoperirile legate de GRIN2A nu răstoarnă acest model, dar adaugă nuanțe importante: unele condiții psihiatrice ar putea apărea din mutații rare, cu impact mare, care se comportă mai degrabă ca boli monogenice. Acest lucru are implicații majore pentru diagnostic, consiliere genetică și planificarea tratamentului, în special în cazurile de debut foarte precoce sau când istoricul familial sau comorbiditatea cu epilepsia sugerează o cauză neurodezvoltamentală subiacentă.
Pentru clinicieni, aceasta înseamnă reorientarea practică a unor investigații: includerea panourilor genetice sau a secvențierii genomice în protocoalele de evaluare pentru pacienții tineri cu simptome psihiatrice severe, refractare la tratament sau însoțite de fenomene neurologice. De asemenea, rezultatele stimulează colaborarea interdisciplinară între psihiatrie, neurologie pediatrică, genetică medicală și cercetare funcțională în laboratoare de neuroștiințe.
Din perspectivă științifică, existența unor mutații cu efect mare oferă modelul ideal pentru studiile mecanistice: analiza efectelor moleculare și celulare ale variantelor GRIN2A, recrearea acestora în sisteme celulare sau animale, și testarea intervențiilor farmacologice în modele preclinice. Aceste demersuri pot accelera traducerea descoperirilor fundamentale în intervenții clinice eficiente.
Pașii următori pentru cercetare
Rămân deschise întrebări-cheie. În ce mod specific variantele diferite ale GRIN2A modifică funcția receptorului și circuitele neurale? Ce pacienți sunt cei mai susceptibili să beneficieze de intervenții care vizează receptorul NMDA, cum ar fi L-serina sau alți modulători? Care sunt biomarker-ii predictivi de răspuns la tratament? Pentru a răspunde acestor întrebări sunt necesare cohorte mai mari, studii funcționale în laborator (in vitro și in vivo), precum și trialuri clinice controlate care să evalueze siguranța și eficacitatea tratamentelor țintite.
Studii funcționale pot include exprimarea variantelor GRIN2A în lignaje neuronale derivate din celule stem pluripotente induse (iPSC) obținute de la pacienți, teste de electrofiziologie pentru a caracteriza curenții NMDA, imagistică funcțională pentru a evalua rețelele cerebrale afectate și modele animale pentru a examina fenotipurile comportamentale și epilepticile. În același timp, registrul internațional GRIN2A rămâne o resursă esențială pentru detectarea modelelor fenotipice, pentru identificarea variantelor recurente și pentru prioritizarea variantelor care merită evaluări funcționale aprofundate.
De asemenea, sunt necesare norme etice și clinice pentru testarea genetică la copii, incluzând consiliere genetică riguroasă, discuții despre implicațiile unui rezultat pozitiv pentru membrii familiei și planuri clare pentru managementul clinic după confirmarea unei variante patogene. Accesul la terapii experimentale sau la studii clinice trebuie facilitat în contextul unui cadru de îngrijire multidisciplinar.
Concluzii practice pentru clinicieni și familii
Pentru clinicieni și familii, studiul reprezintă un memento că genetica poate uneori oferi o explicație clară pentru simptomele psihiatrice cu debut precoce. Testarea genetică pentru variante GRIN2A poate clarifica diagnosticul și, în cazuri selectate, poate indica tratamente bazate pe mecanisme. Pe măsură ce dovezile se acumulează, abordările genomice de precizie ar putea remodela îngrijirea pentru un subgrup de pacienți cu boli mentale severe, de debut timpuriu.
Recomandări practice pe termen scurt includ: luarea în considerare a testării genetice pentru pacienții pediatrici sau adolescenți cu debut de simptome psihiatrice atipice, refractare la tratament sau în prezența epilepsiei; consult interdisciplinar pentru interpretarea rezultatelor genetice; și includerea pacienților în registre și studii care pot contribui la creșterea bazei de cunoștințe despre GRIN2A și opțiunile terapeutice potențiale.
În final, deși descoperirea nu sugerează că majoritatea tulburărilor psihiatrice sunt monogenice, ea indică un segment clar definit de cazuri în care o singură genă — GRIN2A — poate avea un rol determinant. Identificarea acestor cazuri deschide calea pentru intervenții mai precise, pentru o mai bună înțelegere a mecanismelor bolii și, posibil, pentru rezultate clinice mai bune în viitor.
Sursa: sciencealert

Lasă un Comentariu