10 Minute
O nouă lucrare publicată în Cell descrie o arhitectură genetică comună care unește opt tulburări psihiatrice majore, explicând într-o măsură de ce aceste afecțiuni apar frecvent împreună și se transmit în familii. Cercetarea cartografiază variante genetice specifice care acţionează în multiple etape ale dezvoltării cerebrale şi în diferite tipuri de celule nervoase, oferind piste pentru terapii cu spectru larg.
Ce a descoperit studiul și de ce contează
Analiza s-a concentrat pe opt tulburări cu impact clinic și social major: tulburare din spectrul autist, tulburare de deficit de atenție/hiperactivitate (ADHD), schizofrenie, tulburare bipolară, tulburare depresivă majoră, sindrom Tourette, tulburare obsesiv-compulsivă (TOC) și anorexie nervoasă. Cercetări anterioare de mari dimensiuni identificaseră 109 gene asociate, în combinații diferite, cu aceste condiții. Studiul actual a mers mai departe și a identificat variante genetice particulare și modul în care acestea influențează reglarea genelor în celulele nervoase aflate în dezvoltare.
Context și relevanță pentru clinicieni și cercetători
Există o suprapunere clinică semnificativă între diagnostice: de exemplu, până la 70% dintre persoanele cu autism sau ADHD pot îndeplini, la un moment dat, criteriile pentru cealaltă afecțiune. Acest fenomen de co-apariție şi înrudire familială sugerează cauze genetice comune. Conceptul cheie din acest studiu este pleiotropia, adică aceleași variante genetice care influenţează mai multe trăsături sau tulburări. Investigând cum operează aceste variante în timpul neurodezvoltării, autorii explică mecanismele care pot genera diversitatea clinică observată.
Designul experimental: abordare funcțională și cross-species
Colectarea și selecția variantelor studiate
Echipa de cercetare a compilat aproape 18 000 de variante genetice provenind atât din seturi de gene specifice fiecărei tulburări, cât și din gene partajate între ele. Această colecție a reprezentat un inventar extins de variante candidate, incluzând atât polimorfisme comune, cât și variante reglatorii cu efecte subtile asupra expresiei genice.
Modelul celular: celule precursoare neuronale umane
Variantele au fost introduse în celule progenitoare neuronale umane cultivate, acele celule care, în mod natural, se diferenţiază în neuroni ai cortexului şi în alte tipuri neuronale esenţiale pentru formarea circuitelor cerebrale. Cercetătorii au monitorizat impactul asupra expresiei genice, asupra reţelelor de reglare şi asupra traseelor moleculare pe parcursul unei dezvoltări simulate in vitro. Acest tip de experiment permite identificarea variabilelor care modifică activitatea promotorilor și a elementelor enhancere, influențând astfel când și unde sunt exprimate anumite gene.
Validare în modele animale și relevanţă cross-species
Pentru a confirma relevanţa funcţională a unor variante-cheie, autorii au testat efectele acestora în neuroni în curs de dezvoltare de şoarece. Aceste validări cross-species servesc două scopuri: arată că mecanismele reglatorii pot fi conservate în mamifere şi oferă un cadru experimental pentru studii mecanistice ulterioare. Rezultatele bi-specifice sporesc încrederea că variantele identificate au efecte biologice reale, nu doar asociaţii statistice.
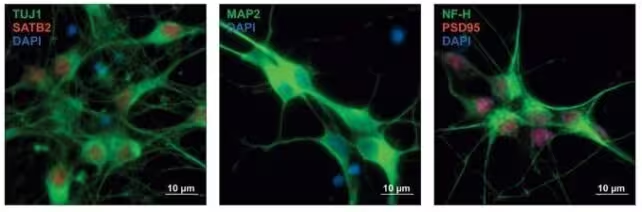
Celule precursoare neuronale umane colorate pentru a indica tipurile neuronale în dezvoltare. Studiul combină date funcţionale cu modele de dezvoltare neuronală pentru a descifra efectele variantelor. (Won et al., Cell, 2025)
Rezultate cheie: pleiotropia expusă la nivel molecular
Autorii au identificat 683 de variante care modifică reglarea genelor în celulele precursoare neuronale. Dintre acestea, variantele clasificate drept pleiotropice au prezentat câteva trăsături definitorii, descrise detaliat mai jos.
1. Conectivitate mai mare în reţele proteină-proteină
Variantele pleiotropice afectează proteine care sunt mult mai conectate în reţelele interacţiunilor proteice decât variantele specifice unei singure tulburări. Practic, aceste proteine acţionează ca hub-uri: o modificare la nivelul lor poate propagă efecte prin multiple căi moleculare, amplificând impactul asupra funcţionării cerebrale. Această observaţie explică de ce unele modificări genetice, chiar dacă par subtile, pot genera efecte largi şi fenotipuri variate.
2. Activitate extinsă în tipuri multiple de celule
Variantele pleiotropice rămân active în mai multe tipuri celulare din creier şi pe ferestre de timp de dezvoltare extinse. Asta înseamnă că aceleaşi schimbări moleculare pot influenţa etape succesive ale formării circuitelor neuronale: de la proliferare şi migraţie, la sinaptogeneză şi plasticitate ulterioră. Contextul celular şi temporal devin astfel factori esenţiali pentru determinarea rezultatului clinic.
3. Efecte în cascadă asupra mecanismelor de reglare
Pleiotropia apare şi pentru că variantele studiate modifică elemente regulatory ce controlează vaste programe de expresie genică. Prin acest mecanism de cascadă, o singură modificare reglatorie poate reseta exprimarea unor reţele de gene implicate în dezvoltare neuronală, metabolism sinaptic sau stabilitate a circuitelor. Efectul final depinde de când şi în ce tip celular apare perturbarea, oferind o explicaţie pentru variabilitatea phenotipică observată clinic.
Potrivit Hyejung Won, genetician la University of North Carolina, proteinele produse de aceste gene sunt foarte conectate cu alte proteine. Schimbările la nivelul acestor noduri pot declanşa efecte extinse în reţea, poziţionând variantele pleiotropice ca puncte cu potenţial ridicat pentru risc, dar şi pentru intervenţie.
Implicaţii pentru diagnostic, clasificare şi tratament
Înţelegerea acestor cauze genetice comune poate schimba abordarea diagnostică şi modul în care dezvoltăm terapii. Pleiotropia a fost, istoric, un complicaţie pentru taxonomia tulburărilor psihiatrice: semnalele genetice nu se aliniau frumos la categoriile clinice tradiţionale. Acum, aceeaşi pleiotropie devine o oportunitate: vizând căi moleculare şi reţele partajate se pot obţine terapii eficiente pentru mai multe condiţii.
Strategii terapeutice potenţiale
- Stabilizarea reţelelor proteină-proteină: medicamentos sau prin mici molecule care restabilesc interacţiuni critice.
- Modularea mecanismelor reglatorii: terapii epigenetice sau molecule care corectează activitatea enhancerelor şi promotorilor afectaţi.
- Intervenţii temporale: tratamente care vizează ferestre de dezvoltare specifice, bazate pe momentul în care o variantă îşi exercită efectul.
- Abordări genetice: editare genică sau terapii pe bază de ARN pentru a atenua efectele variantelor de risc, atunci când sunt clar identificate şi înţelese mecanistic.
Deşi aceste direcţii sunt promiţătoare, există provocări majore: heterogenitatea clinică, riscul de efecte off-target, şi nevoia de biomarkeri care să indice când o terapie ar trebui aplicată. În plus, intervenţiile dezvoltate pe baza rezultatelor din modele in vitro sau animale trebuie validate riguros în contexte clinice diverse.
Organizaţia Mondială a Sănătăţii estimează că aproximativ 1 din 8 persoane la nivel global trăiesc cu o afecţiune psihiatrică, adică aproape un miliard de oameni. Dacă terapiile care vizează cauze comune ar reduce semnificativ povara acestor boli, impactul asupra sănătăţii publice ar fi enorm.
Ce urmează pentru cercetare: paşi practici şi priorităţi
Studiul deschide mai multe direcţii prioritare pentru următoarele etape ale cercetării fundamentale şi aplicate. Iată câteva arii concrete în care se pot concentra eforturile:
1. Cartografiere funcţională la nivel unicelular
Folosirea tehnologiilor single-cell RNA-seq şi ATAC-seq în combinaţie cu editare CRISPR permite disecarea efectelor variantelor în tipuri celulare fine. Acest nivel de rezoluţie e esenţial pentru a înţelege în ce subtipuri neuronale sau gliale apare impactul şi cum se propagă în microcircuite.
2. Studii longitudinale şi modele organoid
Modelele organoid cerebrale şi culturi 3D permit simularea unor etape de dezvoltare mai complexe şi studierea interacţiunilor între populatii celulare. Combinând aceste modele cu analize temporale se pot identifica ferestre critice de vulnerabilitate.
3. Ecrane funcţionale şi măsuri mecanistice
Ecranele CRISPR în neuroni derivaţi din celule stem pluripotente umane (iPSC) pot confirma rolul variantelor candidate şi pot testa compuși care restabilesc fenotipurile perturbate. Acest tip de abordare face trecerea de la asociere la cauzalitate funcţională.
4. Traslarea către biomarkeri clinici
Identificarea unor semnale biologice măsurabile, fie în sânge, fie prin imagistică funcțională, care reflectă dereglări în aceleași rețele, va fi cheia pentru dezvoltarea tratamentelor personalizate și pentru selectarea pacienților în trialuri clinice.
Consideraţii etice și sociale
Progresul în înţelegerea geneticii tulburărilor psihiatrice ridică întrebări etice importante. Testarea genetică, diagnosticul precoce sau intervențiile timpurii pot aduce beneficii, dar pot genera și stigmatizare, discriminare sau decizii complexe pentru părinţi şi profesionişti. Este esenţial ca dezvoltarea testelor şi a terapiilor să fie însoţită de politici clare, consiliere genetică și implicare a comunităților afectate.
Ce pot face clinicianii acum
- Să recunoască frecvenţa comorbidităţilor şi să adopte o abordare integrată în evaluare.
- Să încurajeze participarea pacienţilor la studii care pot oferi informaţii genetice relevante, asigurând consiliere adecvată.
- Să urmărească evoluţiile din domeniu pentru a implementa, când vor fi validate, teste și terapii bazate pe mecanisme partajate.
În practica curentă, testarea genetică rămâne limitată de interpretarea variabilă a rezultatelor şi de lipsa unor intervenţii aprobate direct pe baza unor variante specifice. Totuşi, pe măsură ce harta funcţională devine mai clară, utilitatea clinică a acestor teste va creşte.
Perspective finale
Acest studiu pune bazele unei înțelegeri mai nuanțate a modalităților prin care variantele genetice pleiotropice pot produce un spectru larg de tulburări psihiatrice. Prin identificarea variantelor care influențează rețele reglatorii și hub-urile proteinice, cercetătorii oferă ținte concrete pentru studii funcționale ulterioare și pentru dezvoltarea de strategii terapeutice care nu mai tratează doar simptome, ci încearcă să restabilească integritatea rețelelor moleculare implicate în neurodezvoltare.
Următorii pași includ validări mecanistice, dezvoltarea de biomarkeri și testarea unor abordări terapeutice orientate pe rețele. Pe termen lung, integrarea datelor genetice, moleculare și clinice ar putea transforma modul în care clasificăm și tratăm tulburările psihiatrice, făcând posibilă o medicină mai precisă și cu impact public deosebit.
Sursa: sciencealert

Lasă un Comentariu