8 Minute
Cercetătorii de la Oregon Health & Science University (OHSU) raportează o moleculă revoluţionară, SU212, care degradează selectiv o enzimă asociată cu metabolismul tumoral agresiv. Testele iniţiale într-un model de şoarece umanizat arată reducerea creşterii şi a metastazării în cancerul mamar triplu negativ (TNBC), sporind speranţa pentru o nouă terapie într-un domeniu în care opţiunile sunt în prezent limitate.
Echipa de cercetare a dezvoltat o moleculă denumită SU212 care ar putea schimba paradigma tratamentului pentru cancerul mamar triplu negativ, una dintre formele cele mai agresive şi mai greu de tratat ale bolii. Pe termen lung, această moleculă ar putea fi utilă şi în tratamentul altor tipuri de cancer în care aceeaşi enzimă joacă un rol important, precum gliomul, cancerul pancreatic şi carcinomul tiroidian, extinzând potenţial aplicabilitatea terapeutică la nevoi clinice mari.
Targeting tumor metabolism: how SU212 works
SU212 se leagă de enolaza 1 (ENO1), o enzimă cheie în glicoliză care ajută celulele canceroase să proceseze glucoza pentru obţinerea energiei. ENO1 este frecvent supraexprimată în numeroase tipuri de tumori, contribuind la creşterea rapidă şi la supravieţuirea celulelor neoplazice. Echipa OHSU a constatat că odată ce SU212 se leagă de ENO1, se declanşează degradarea enzimei, ceea ce privează celulele tumorale de un avantaj metabolic important şi încetineşte proliferarea celulară.
Într-un model de şoarece umanizat conceput pentru a reda mai fidel biologia umană, tratamentul cu SU212 a suprimat creşterea tumorii primare şi a redus incidenţa metastazelor. Aceste rezultate preclinice sugerează o abordare mecanistică de atacare a TNBC, un subtip lipsit de receptori pentru estrogen, progesteron şi HER2 şi, prin urmare, neresponsiv la multe terapii ţintite convenţionale. Rezultatele pun accentul pe potenţialul unei terapii direcţionate asupra metabolicii tumorale, care ar putea completa sau îmbunătăţi regimurile existente de chimioterapie.
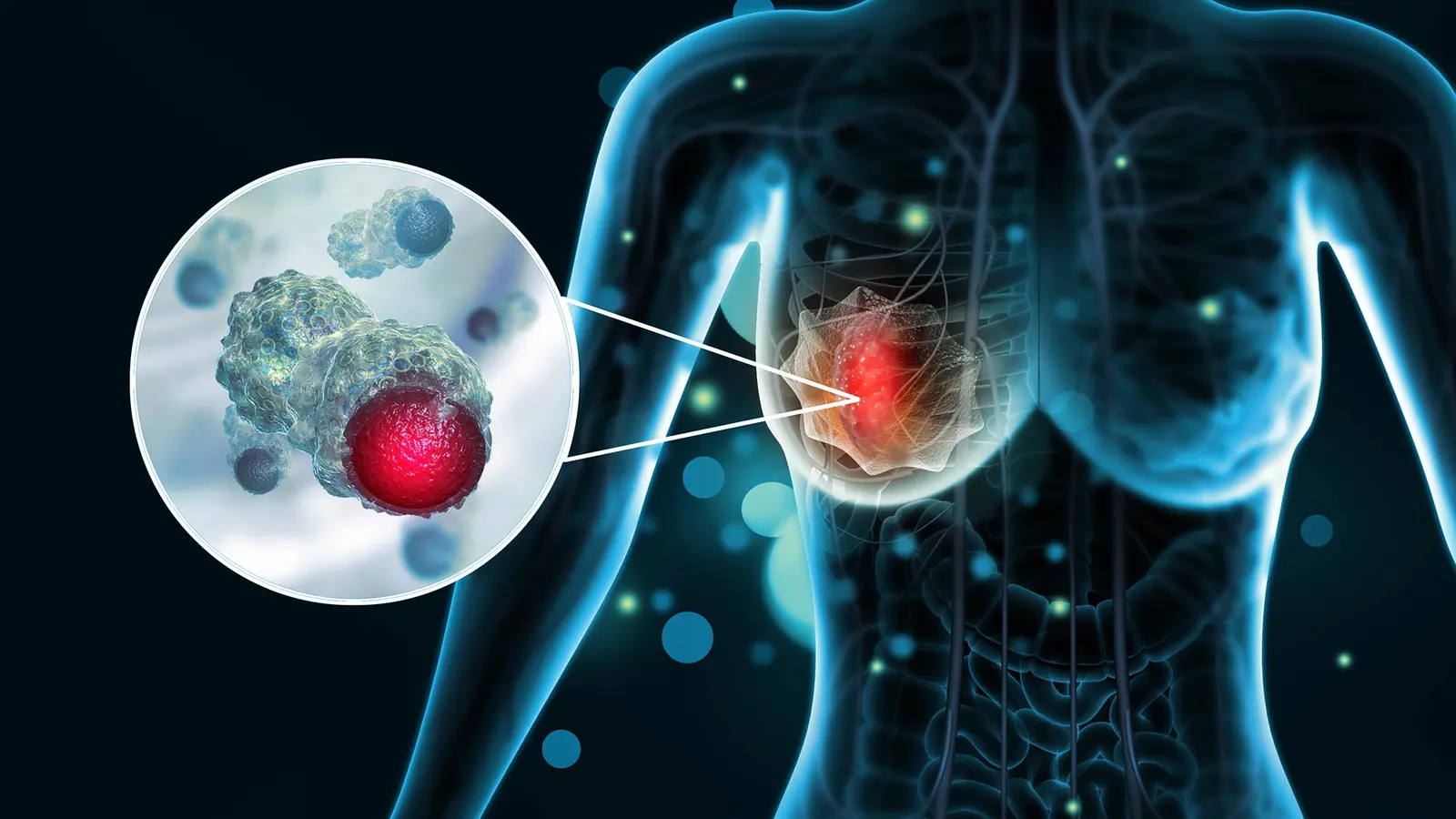
Why this matters for triple-negative breast cancer
Cancerul mamar triplu negativ reprezintă aproximativ 10–15% din cazurile de cancer mamar şi este recunoscut pentru comportamentul clinic agresiv şi pentru opţiunile terapeutice limitate. Chimioterapia standard rămâne baza tratamentului, dar prognosticul este adesea mai nefavorabil comparativ cu subtipurile receptor-pozitive. În acest context, un agent ţintit care interferează cu metabolismul celular al tumorii, în special prin degradarea unei enzime critice precum ENO1, ar putea extinde arsenalul terapeutic pentru TNBC şi oferi o speranţă reală pacienţilor cu boală avansată.
Potential benefits beyond breast cancer
Deoarece ENO1 este implicată în progresia altor tipuri de tumori, SU212 poate avea aplicaţii mai largi. Cercetătorii OHSU semnalează gliomul, cancerul pancreatic şi carcinomul tiroidian ca exemple în care metabolismul condus de ENO1 contribuie la agresivitatea tumorală. Dacă testele clinice vor confirma siguranţa şi eficacitatea, SU212 sau molecule similare care vizează ENO1 ar putea constitui o strategie terapeutică comună pentru mai multe cancere cu nevoie mare de tratamente noi.
Cercetările recente indică faptul că un medicament dezvoltat de oamenii de ştiinţă de la Oregon Health & Science University ar putea evolua către un tratament pentru o formă deosebit de agresivă de cancer mamar. Credit: Oregon Health & Science University
From bench to bedside: next steps and challenges
Deplasarea SU212 către studiile clinice pe oameni va necesita resurse substanţiale: finanţare pentru producţie la scară, studii toxiceologice, aprobări reglementare de la autorităţi precum U.S. Food and Drug Administration (FDA), precum şi proiectarea atentă a studiilor de fază I pentru evaluarea siguranţei şi stabilirii dozei. Este esenţială evaluarea efectelor off-target, a durabilităţii răspunsului şi a modului în care molecula interacţionează cu terapiile standard, inclusiv chimioterapia şi terapiile imunologice (imunoterapie).
Conducătorul proiectului, Sanjay V. Malhotra, Ph.D., din Center for Experimental Therapeutics al OHSU, pune accent pe translarea descoperirilor din laborator către testarea clinică. El şi colegii săi intenţionează să accelereze aceste descoperiri, dar recunosc obstacolele reglementare şi logistice care urmează. În mod special, interacţiunile metabolice pot determina ca SU212 să aibă efecte diferite la pacienţi cu comorbidităţi metabolice, precum diabetul zaharat; de aceea, proiectarea studiilor clinice va trebui să ia în calcul statutul metabolic al pacienţilor şi biomarkerii activităţii ENO1 pentru o selecţie şi monitorizare precisă.
Paşii cheie pentru avansarea includ optimizarea profilului farmacocinetic şi farmacodinamic al SU212, stabilirea unei formulări stabile pentru administrare, analiza distribuţiei tisulare şi a capacităţii de penetrare a ţesuturilor tumorale, precum şi studii ample de toxicitate cronică şi reproductivă la modele animale relevante. Controlul calităţii producţiei şi scalarea sintezei chimice sau a proceselor de fabricaţie sunt, de asemenea, esenţiale pentru pregătirea dosarelor către autorităţi şi pentru derularea unui studiu de fază I robust.
Scientific context: ENO1 and cancer metabolism
Enolaza 1 (ENO1) este o enzimă implicată în glicoliză, calea metabolică fundamentală prin care celulele descompun glucoza pentru a obţine energie şi metaboliţi esenţiali. Celulele canceroase reconfigurează adesea metabolismul pentru a favoriza glicoliza chiar şi în prezenţa oxigenului, fenomen cunoscut sub numele de efectul Warburg. Această adaptare permite tumoralui să obţină ATP rapid şi intermediari pentru sinteza biomoleculelor necesare proliferării aggressive. Din acest motiv, enzimele glicolitice, inclusiv ENO1, sunt ţinte atractive pentru dezvoltarea de noi terapii anticancer.
Abordarea folosită de SU212 — determinarea degradării ENO1 în loc de simpla inhibare enzimatică — poate genera un impact mai puternic şi mai durabil asupra metabolismului tumoral. În loc să blocheze temporar activitatea enzymatică, declanşarea degradării reduce efectiv nivelul proteinelor ţintite în celulă, diminuând capacitatea tumorii de a compensa prin creşterea expresiei proteinei ţintă. Această strategie se aliniază cu tendinţele moderne în proiectarea medicamentelor, cum ar fi proteolysis-targeting chimeras (PROTACs), care vizează eliminarea proteinelor patogenice din celulă, nu doar blocarea lor.
Deşi mecanismul exact molecular al degradării induse de SU212 necesită clarificare suplimentară, ipotezele includ recrutarea unor componente ale sistemului ubiquitin‑proteazom sau alte mecanisme de degradare proteică dependente de mașinării celulare interne. Investigaţii biochimice detaliate, studii de cristalografie sau criomicroscopie, precum şi experimente de proteomică vor fi necesare pentru a determina interacţiunile directe, calea de degradare şi posibilele efecte secundare la nivel celular.
Future prospects and clinical implications
Dacă studiile clinice vor valida siguranţa şi activitatea antitumorală observată în preclinic, SU212 ar putea fi integrat în regimuri combinate care includ chimioterapie, terapii ţintite sau imunoterapii. Combinarea unui agent metabolic cu alţi agenţi terapeutici poate creşte eficacitatea prin atac simultan asupra mai multor vulnerabilităţi ale celulei tumorale şi prin reducerea riscului de apariţie a rezistenţei. De exemplu, suprimarea metabolismului glicolitic poate sensibiliza tumora la inhibitori de puncte de control imunitar sau poate reduce capacitatea celulelor canceroase de a gestiona stresul oxidativ generat de chimioterapie.
Dezvoltarea de biomarkeri va fi un element cheie: măsurarea expresiei ENO1, a semnăturilor metabolice (profiluri metabolomice), sau a altor markeri predictivi ar putea identifica pacienţii cu probabilitate crescută de răspuns. Tehnici precum imunohistochimia, secvenţierea ARN, sau spectrometria de masă pentru metabolomica pot fi folosite în testele clinice pentru stratificarea pacienţilor şi monitorizarea răspunsului terapeutic. Astfel, terapia devine mai personalizată şi eficientă, reducând expunerea inutilă la tratamente ineficiente.
Pe termen lung, medicamente care exploatează vulnerabilităţile metabolice ale tumorii ar putea modifica paradigmele de tratament pentru cancere agresive. Integrarea cunoştinţelor despre metabolismul tumoral cu terapiile convenţionale şi cu progresele în biologie moleculară poate conduce la regimuri terapeutice mai precise şi la îmbunătăţiri semnificative ale supravieţuirii şi calităţii vieţii pacienţilor.
Expert Insight
"Targetarea metabolismului tumoral este o direcţie din ce în ce mai promiţătoare, iar o moleculă care induce degradarea ENO1 reprezintă o abordare elegantă", spune Dr. Elena Rivera, oncolog medical neafiliată studiului. "Rezultatele timpurii la animale sunt încurajatoare, dar studiile pe oameni vor determina dacă această strategie se traduce într-un beneficiu clinic semnificativ, în special în populaţii diverse de pacienţi."
Rezultatele OHSU constituie un jalon preclinic important. Lunile şi anii următori vor arăta dacă SU212 poate traversa prăpastia translatională şi poate deveni o opţiune terapeutică pentru pacienţii confruntaţi cu una dintre cele mai dificile forme de cancer mamar. Între timp, comunitatea ştiinţifică va urmări cu atenţie optimizarea chimică a SU212, studiile toxicologice, designul clinic şi dezvoltarea biomarkerilor de selecţie, toate fiind componente esenţiale pentru succesul unei terapii noi axate pe metabolismul tumoral.
Sursa: scitechdaily

Lasă un Comentariu