9 Minute
Cercetătorii de la Johns Hopkins Medicine au identificat canale microscopice sub formă de nanotuburi între neuroni care pot transporta molecule toxice — o descoperire care adaugă un strat anterior neidentificat la conectivitatea creierului și care poate ajuta la explicarea modului în care patologia Alzheimer se răspândește. Folosind imagistică de înaltă rezoluție la șoareci și seturi de date umane de microscopie electronică, echipa a observat nanotuburi dendritice lungi și subțiri care transportă amiloid‑beta și alte toxine mici între celule, sugerând un nou țel pentru terapii viitoare.
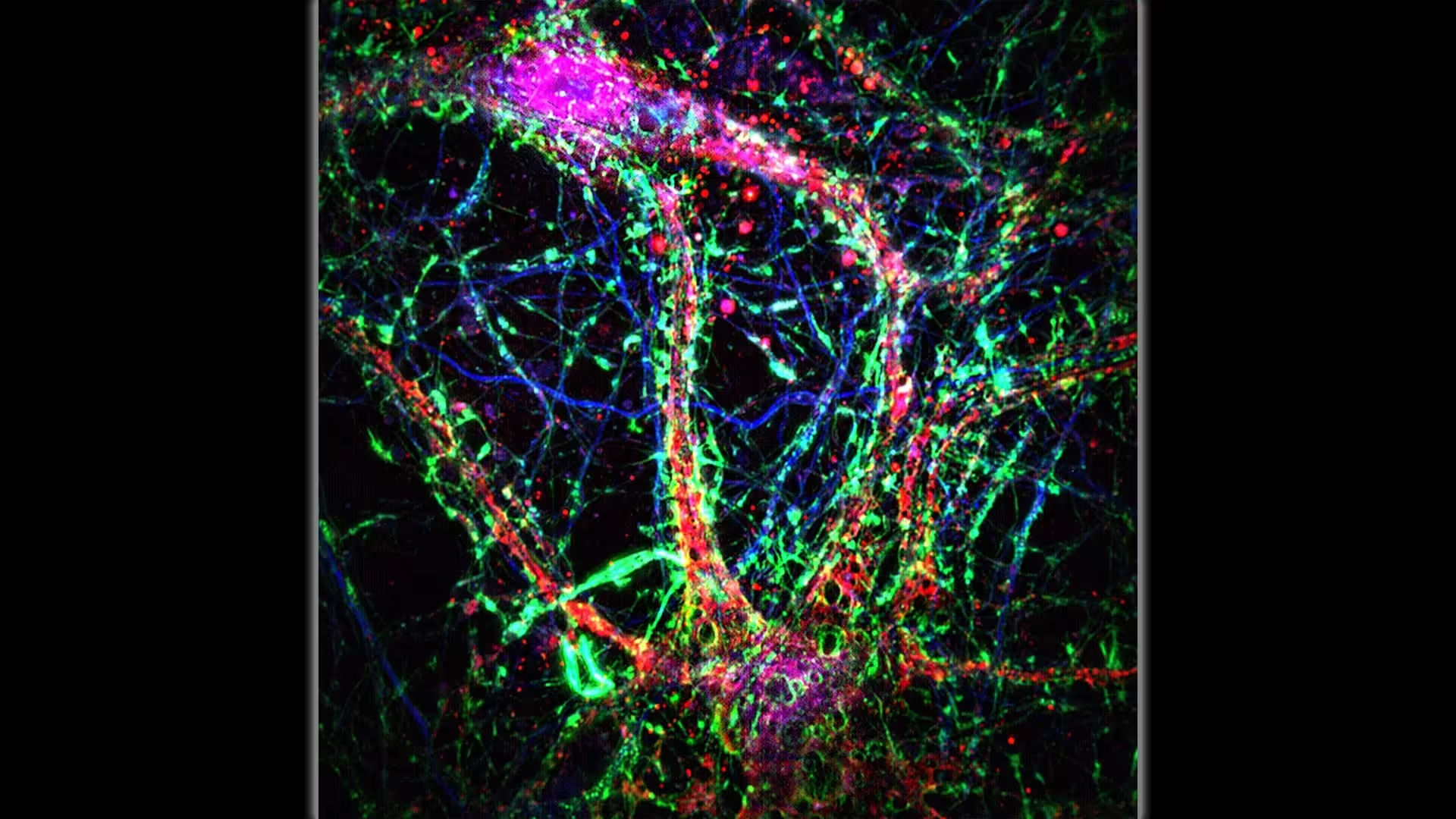
Oamenii de știință de la Johns Hopkins Medicine afirmă că nanotuburile intercelulare (conexiuni subțiri, cu nuanță predominant verde, asemănătoare unor poduri) adaugă un strat suplimentar de comunicare în cadrul rețelei neuronale. Credit: Minhyeok Chang, Ph.D.
Ce a descoperit echipa și de ce contează
Gândiți‑vă la neuroni care nu comunică doar prin sinapse, ci și prin transferul unor „pachete” foarte mici prin poduri tubulare. Aceasta este imaginea de ansamblu care rezultă dintr‑un studiu publicat în Science pe 2 octombrie, în care investigatori descriu un „strat de conectivitate nanotubulară” în creierul mamiferelor. Aceste nanotuburi — canale membranare extrem de subțiri ce leagă dendritele neuronilor vecini — par să transporte ioni, calciu și molecule toxice mici, precum peptidele amiloid‑beta, de la o celulă la alta.
Rolul acestor conexiuni nu este unidimensional: ele pot facilita atât schimbul rapid de ioni care susține funcția neuronală locală, cât și transferul de fragmente proteice sau de resturi celulare. În termeni biologici, nanotuburile dendritice reprezintă o cale de comunicare intercelulară care completează sinapsa chimică și conexiunile electrice, oferind un mecanism direct pentru transportul unor molecule care anterior erau considerate strict „extracelulare” sau limitate la proximitatea sinaptică.
„Celulele trebuie să elimine moleculele toxice, iar prin formarea unui nanotub ele pot transmite această moleculă toxică către o celulă vecină”, a explicat Hyungbae Kwon, profesor asociat de neuroștiințe la Johns Hopkins University School of Medicine și autorul de corespondență al lucrării. „Din păcate, acest mecanism poate duce la răspândirea proteinelor dăunătoare către alte regiuni ale creierului.” Această observație pune în lumină o tensiune biologică importantă: mecanismele naturale de evacuare a deșeurilor celulare pot, accidental, să favorizeze diseminarea agenților patologici.
Natura duală a nanotuburilor — ca mijloc de clearance celular și, în același timp, ca rută pentru încărcături toxice — oferă neuoroscienței un cadru conceptual nou pentru înțelegerea degenerării neuronale timpurii. Simulările pe calculator realizate de echipă au reprodus tipare de acumulare timpurie a amiloidului observate la șoarecii cu model de Alzheimer, consolidând ipoteza că transferul mediat de nanotuburi ar putea accelera „seeding”-ul local al proteinelor patologice și inițierea agregatelor proteice în micro‑rețele neuronale.
Cum a fost făcută descoperirea: metode și dovezi
Cercetătorii au combinat modele genetice la șoareci, predispuse la acumularea de amiloid, cu microscopie live de înaltă rezoluție pentru a vizualiza formarea nanotuburilor în felii de țesut cerebral. Folosind markeri fluorescenți și imagistică în timp real, au surprins extensii lungi, coloanele tubulare care se întind între dendrite, și au urmărit direct deplasarea moleculelor etichetate fluorescent prin aceste conducte. Urmărirea dinamicii moleculelor a demonstrat transportul directional al unor fragmente de proteine și compuși ionici, inclusiv a speciilor asociate cu stres oxidativ și agregare proteică.
Pentru a verifica relevanța pentru creierul uman, echipa a analizat seturi de date publice de microscopie electronică umană și a identificat nanotuburi cu morfologie comparabilă, care leagă neuronii din țesut cerebral uman. Această validare cross‑specii este esențială pentru traducerea observațiilor din modele animale către înțelegerea bolilor neurodegenerative umane, deoarece diferențele de scară, structură și compoziție pot modifica semnificativ relevanța clinică.
La șoarecii programați genetic să dezvolte plăci amiloide asemănătoare celor din Alzheimer, numărul de nanotuburi era crescut la vârsta de trei luni — o etapă când animalele nu prezintă simptome externe evidente. Până la șase luni, când patologia plăcilor devine mai pronunțată, numărul nanotuburilor între șoarecii transgenici și cei de control a convergat. Aceste dinamici temporale sugerează că proliferarea nanotuburilor poate fi mai activă în fazele timpurii, pre‑simptomatice, ale bolii — o perioadă critică pentru identificarea biomarkerilor și pentru intervențiile terapeutice timpurii.
Echipa de suport și finanțare
Proiectul a fost condus de Kwon, cu contribuții semnificative din partea lui Minhyeok Chang, Sarah Krüssel, Juhyun Kim, Daniel Lee, Alec Merodio și Jaeyoung Kwon de la Johns Hopkins, precum și a colaboratorilor Laxmi Kumar Parajuli și Shigeo Okabe de la University of Tokyo. Finanțarea a fost asigurată de National Institutes of Health (DP1MH119428 și R01NS138176). Suportul financiar și colaborările internaționale au fost cruciale atât pentru achiziția echipamentelor de imagistică de înaltă rezoluție, cât și pentru analiza datelor și interpretarea morfologiei nanotubulare.
Implicații pentru cercetarea Alzheimer și terapii potențiale
Aceste descoperiri deschid multiple direcții de traducere clinică. Dacă nanotuburile dendritice reprezintă o rută pentru răspândirea amiloid‑beta, modularea formării lor — fie prin suprimare pentru a limita propagarea, fie prin activare tranzitorie pentru a îmbunătăți clearance‑ul moleculelor toxice — ar putea deveni o strategie terapeutică inovatoare. Echipa lui Kwon propune experimente viitoare care să creeze deliberat nanotuburi sau să le blocheze, pentru a testa modul în care manipularea acestor rețele afectează sănătatea neuronală, agregarea proteinelor și performanța cognitivă la modelele animale.
În termeni de dezvoltare a medicamentelor, rezultatele sugerează că moleculele mici, anticorpii direcționați sau biologicele proiectate ar putea viza componente moleculare ale membranei nanotubulare, proteine asociate cu asamblarea acestora sau semnalizarea care reglează formarea lor. Abordări bazate pe gene (de exemplu, silențarea temporară a unor factori necesari formării nanotuburilor) ar putea fi testate în modele preclinice pentru a evalua beneficiile și riscurile. Totuși, orice intervenție trebuie să echilibreze reducerea răspândirii proteinelor patologice cu păstrarea funcțiilor benefice de transport și clearance celular.
Dincolo de boala Alzheimer, rețelele nanotubulare ar putea juca roluri în alte boli neurodegenerative în care proteinele malpliate se propagă de la o celulă la alta, cum ar fi boala Parkinson, scleroza laterală amiotrofică (ALS) sau alte tulburări proteinopathice. Caracteristicile structurale și funcționale ale acestor nanotuburi — lungimea lor, diametrul, permeabilitatea și selecția pentru anumite tipuri de cargo molecular — vor fi detalii cruciale pentru cercetători și dezvoltatorii de medicamente. În plus, înțelegerea semnalelor care induc formarea nanotuburilor în contexte de stres celular, inflamație sau disfuncție mitocondrială poate oferi ținte suplimentare pentru intervenții farmacologice.
Perspectiva expertă
„Această descoperire adaugă un nou strat la harta noastră a comunicării neuronale”, a declarat dr. Elena Vargas, neurobiologă fictivă și comunicatoare științifică cu experiență în studiul agregării proteice. „Reformează modul în care privim eliminarea deșeurilor celulare și consecințele neintenționate ale acestor mecanisme. Țintirea dinamicii nanotuburilor ar putea fi o abordare ingenioasă pentru a interveni timpuriu în progresia bolii, însă sunt necesare studii riguroase pentru a nu perturba căile benefice de clearance.”
Următorii pași pentru echipa de la Johns Hopkins includ cartografierea rețelelor de nanotuburi între diferite tipuri de celule cerebrale (neuroni excitatori și inhibitori, celule gliale, celule microgliale), ingineria controlată a formării nanotuburilor in vitro și testarea dacă modificarea frecvenței nanotuburilor schimbă cursul amiloidozei in vivo. Dacă aceste direcții se dovedesc fructuoase, ele ar putea indica ținte medicamentoase sau biologice proiectate să moduleze selectiv activitatea nanotuburală intercelulară.
Pe plan clinic, această perspectivă poate influența modul în care cercetătorii caută biomarkeri timpurii, relevanți pentru fazele pre‑simptomatice ale bolii Alzheimer. De exemplu, detectarea în lichidul cefalorahidian sau în țesuturi periferice a fragmentelor proteice transportate prin nanotuburi, a markerilor asociați cu membranele nanotubulare sau a semnalelor care indică proliferarea acestor structuri ar putea servi ca indicatori pentru intervenții precoce sau pentru monitorizarea eficacității tratamentelor care vizează aceste căi.
În esență, descoperirea rafinează perspectiva noastră asupra patologiei timpurii a Alzheimer: nu doar ca formare localizată de plăci, ci ca un proces dinamic influențat de conducte microscopice care leagă comunități neuronale. Această nouă abordare conceptuală poate modela modul în care cercetătorii caută biomarkeri și proiectează intervenții timpurii pentru a încetini sau opri răspândirea bolii.
Pe măsură ce studiile se extind, vor fi necesare colaborări interdisciplinare punând laolaltă neuroștiința, biologia moleculară, bioingineria, modelarea computațională și dezvoltarea de medicamente. Numai printr‑un efort integrat se poate avansa de la observații mecanistice la strategii terapeutice sigure și eficiente, menite să reducă povara bolii Alzheimer și a altor neurodegenerescențe asociate cu propagarea proteinelor patologice.
Sursa: sciencedaily

Lasă un Comentariu