11 Minute
Transplantul de celule stem inversează leziunile produse de accidentul vascular la șoareci
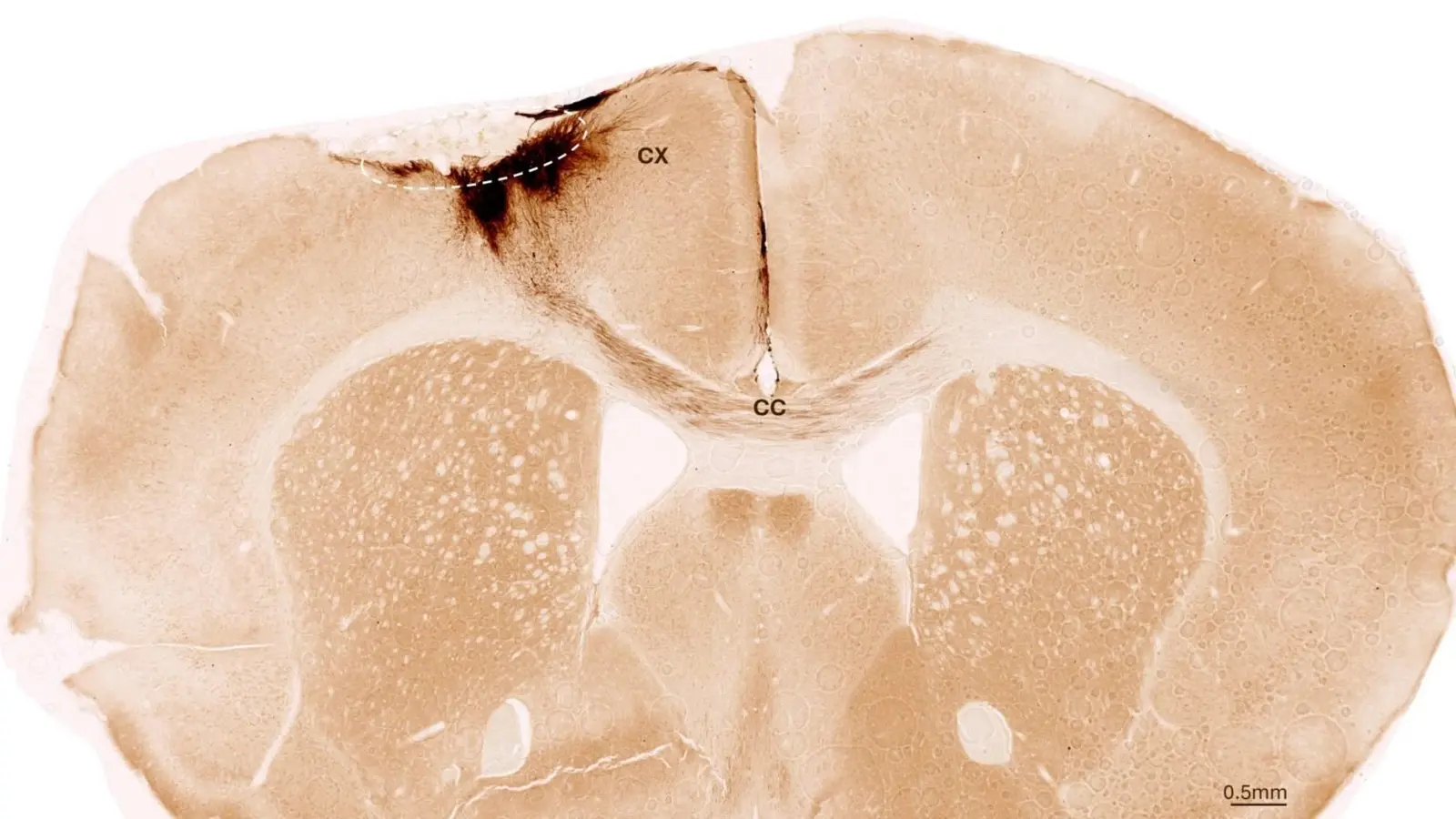
Această imagine prezintă o secțiune coronală prin creierul unui șoarece după accident vascular și transplant de celule stem neurale. Cerculețul punctat indică zona afectată de accident. Proiecțiile de neurite ale celulelor umane transplantate sunt colorate în maro închis. Neuritele se extind local în cortex (CX), dar și prin corpul calos (CC) către emisfera opusă. Credit: University of Zurich
Cercetători de la Universitatea din Zurich (UZH), în colaborare cu echipe din Statele Unite și Japonia, au demonstrat că celulele stem neurale umane pot regenera țesut cerebral afectat după un accident vascular în modele experimentale la șoareci. Celulele transplantate au supraviețuit săptămâni la rând, s-au diferențiat în neuroni care s-au integrat în circuitele gazdă și au declanșat procese de reparare mai largi, care au condus la îmbunătățiri ale funcției motorii. Aceste constatări reprezintă un pas important spre strategii clinice care vizează regenerarea și recuperarea după AVC.
Context științific și proiect experimental
Accidentul vascular cerebral (AVC) este una dintre principalele cauze ale dizabilității la adulți la nivel mondial; statisticile sugerează că aproximativ unul din patru adulți va suferi un AVC pe parcursul vieții. Atât AVC-ul ischemic, cât și hemoragia intracerebrală provoacă pierderea de neuroni și alte celule cerebrale, adesea cu efecte ireversibile care includ deficite în mobilitate, vorbire și funcții cognitive. Tratamentele actuale se axează în principal pe limitarea leziunii acute și pe intervenții de reabilitare; în momentul de față nu există o terapie standard care să poată înlocui neuronii pierduți sau să reconstruiască complet țesutul cerebral.
Pentru a investiga dacă celulele stem neurale pot reconstrui un țesut cerebral lezat, echipele au folosit celule stem neurale umane obținute din celule stem pluripotente induse (iPSC). iPSC-urile provin din celule somatice adulte reprogramate într-o stare pluripotentă și apoi diferențiate în progenitori neurali capabili să genereze mai multe tipuri celulare neuronale și gliale. Acest traseu oferă posibilitatea de a produce material celular uman adaptabil, testabil din punct de vedere al siguranței și apt pentru modificări genetice sau funcționale înainte de utilizare clinică.
Protocolul experimental a implicat inducerea unui accident vascular focal permanent la șoareci, model conceput pentru a reproduce caracteristici patologice și comportamentale relevante pentru AVC la om. Animalele au fost modificate imunologic pentru a reduce respingerea xenogenică a celulelor umane, permițând astfel urmărirea pe termen lung a soartei grefei. Transplantul a fost efectuat la o săptămână după producerea leziunii — un interval deliberat ales pentru a semăna cu o fereastră clinică realistă și pentru a permite stabilizarea mediului local înainte de implantare.
Calitatea și siguranța liniei de iPSC și a liniilor diferențiate au fost controlate riguros în studiu: s-au evaluat stabilitatea genomică, potențialul tumorigenic în testele in vitro și in vivo, sterilitățile și nivelele de endotoxină, precum și eficiența diferențierii către fenotipuri neurale specifice. Aceste măsuri de control al calității sunt cruciale pentru orice demers care urmărește tranziția de la modelul animal la testarea clinică la om.
Pentru evaluarea rezultatelor, echipa a aplicat o abordare multimodală: histologie și imunocolorare pentru a urmări supraviețuirea și diferențierea celulară; teste moleculare pentru a cuantifica inflamația, semnalele angiogene și integritatea vasculară; și imagistică de înaltă rezoluție — inclusiv microscopie confocală și tehnici optice tridimensionale — pentru a investiga integrarea structurală. Recuperarea funcțională a fost măsurată prin analize comportamentale automate, folosind sisteme asistate de inteligență artificială pentru a detecta modificări subtile ale mersului, simetriei pașilor și utilizării membrelor.
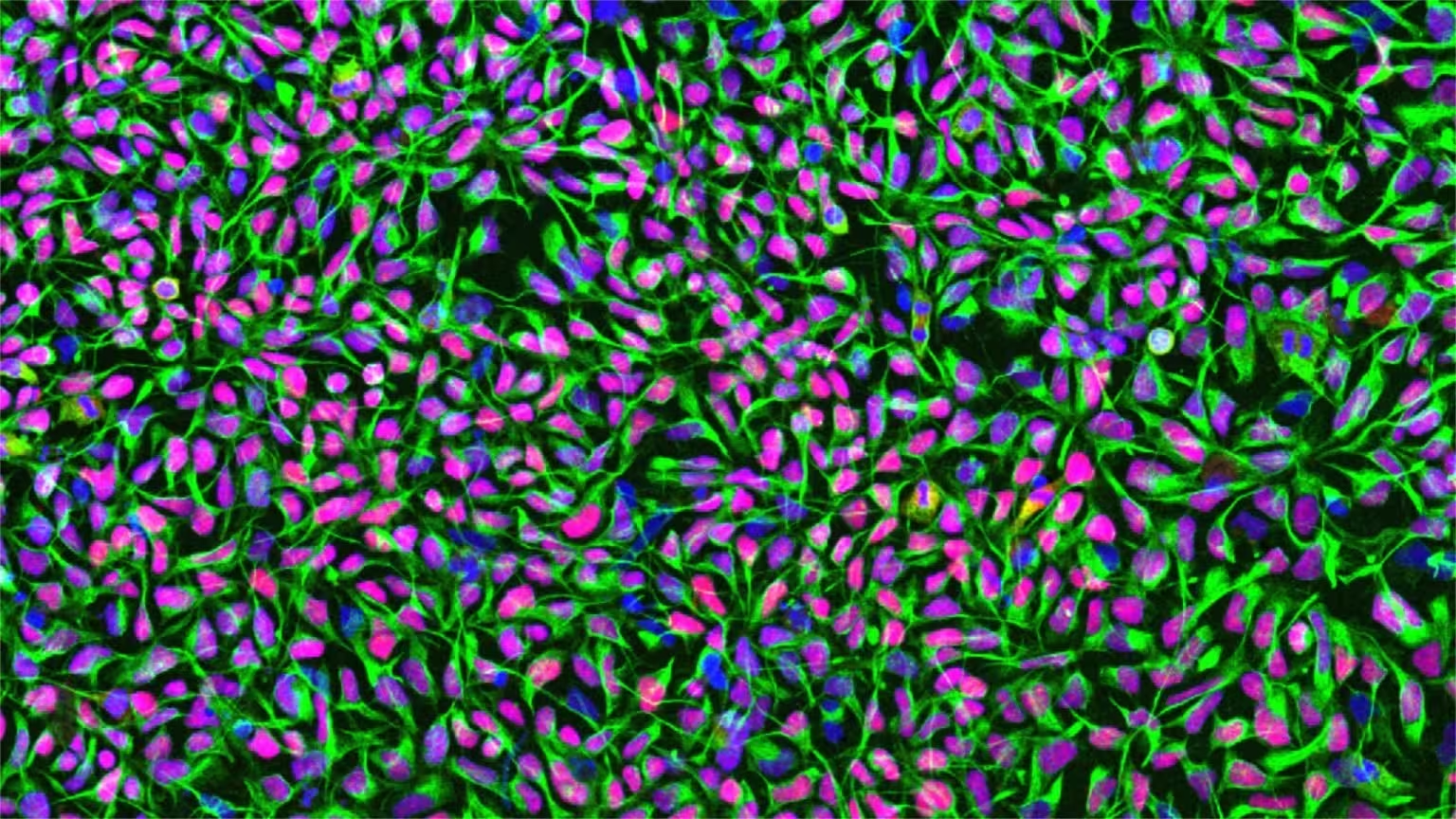
Celule stem neurale umane în cultură. Nucleii celulelor sunt colorați în albastru, proteina filamentară specifică celulelor stem neurale Nestin este prezentată în verde, iar factorul de transcripție Sox1 în roșu. Credit: University of Zurich
Descoperiri majore: neurogeneză și reparare sistemică
Celulele stem neurale umane transplantate au supraviețuit pe întreaga perioadă de observație de cinci săptămâni și s-au diferențiat în majoritate în neuroni. Multe dintre celulele nou formate au extins neurite și au arătat semne de formare a conexiunilor sinaptice, ceea ce indică o integrare funcțională în circuitele locale și, în unele cazuri, cu regiuni aflate la distanță prin corpul calos. Evaluări complementare, precum marcajele presinaptice și postsinaptice, au ajutat la identificarea unor potențiale sinapse între celulele transplantate și neuroni gazdă.
Pentru a verifica funcționalitatea, cercetătorii au folosit tehnici electrophiziologice și de imagistică Ca2+ în preparate acute, observând potențiale post-sinaptice care sugerează că celulele transplantate pot primi și transmite semnale electrice. Aceste dovezi electrofiziologice completează datele anatomice și sunt esențiale pentru a demonstra că grefa nu este doar viabilă, ci contribuie activ la activitatea rețelelor neurale.
Pe lângă neurogeneză directă, s-au observat efecte regenerative adiționale relevante:
- Angiogeneză și refacere vasculară: marcatori precum CD31 și semnalele pro-angiogene (de ex. VEGF) au fost mai prezenți în și în jurul leziunii, indicând formarea de vase noi care susțin aportul metabolic necesar pentru regiunea în curs de regenerare.
- Reducerea inflamației: răspunsurile inflamatorii locale — care pot agrava leziunea secundară — au fost temperate după transplant. S-au constatat modificări în profilul macrofagelor/microgliilor (de ex. scăderea markerilor pro-inflamatorii Iba1/CD68 și modificarea nivelurilor de citokine precum IL-1β și TNF-α) și o creștere relativă a semnalelor anti-inflamatorii (de ex. IL-10).
- Îmbunătățirea integrității barierei hemato-encefalice (BHE): teste funcționale ale permeabilității (de tipul tracerilor) și analize ale proteinelor tight junction (claudin-5, occludin) au indicat o restaurare parțială a compartimentării micro-mediului cerebral, limitând pătrunderea moleculelor potențial dăunătoare.
Combinația acestor procese a creat un microambient mai permisiv pentru regenerare și pentru refacerea funcțională. Testele comportamentale au arătat o ameliorare semnificativă a deficitelor motorii induse de AVC: animalele care au primit celule stem au prezentat o îmbunătățire a paramentrilor de mers, simetriei pașilor și utilizării membrelor, comparativ cu grupurile control. Analizele statistice au arătat corelații între gradul de recuperare și parametrii biologici, precum densitatea neuritelor transplantate și măsurile de restaurare vasculară, sugerând efecte sinergice între neurogeneză și repararea microvasculară.
Totuși, este important de subliniat limitările: creierul șoarecelui este mult mai mic și are o arhitectură diferită față de creierul uman, ceea ce ridică întrebări despre scalabilitate și despre cât de ușor pot fi replicate aceste efecte în cortexul uman. De asemenea, răspunsurile imune și dinamica vindecării sunt distincte între specii, astfel încât succesul la rozătoare nu garantează rezultate identice în clinici.
Considerații de translație și strategii de siguranță
În vederea aplicării clinice, echipa a produs celulele stem folosind protocoale fără componente de origine animală (xeno-free), o condiție care influențează favorabil cerințele regulatorii și reduce riscul de contaminare cu agenți zoonotici. Această colaborare cu Center for iPS Cell Research and Application (CiRA) de la Universitatea din Kyoto a facilitat adoptarea unor proceduri de fabricație conforme cu bunele practici de fabricație (GMP).
Momentul administrării a rezultat a fi o variabilă esențială: transplantele efectuate la o săptămână după accident au produs rezultate mai bune decât transplanturile imediate. Această fereastră poate facilita logistica clinică, permițând validări suplimentare ale produsului celular și selecția pacienților potriviți înainte de intervenție.
Securitatea rămâne primordiala. Investigatori dezvoltă mecanisme de control al grefei, cum ar fi sisteme «safety switch» bazate pe gene care pot fi activate farmacologic pentru a elimina celulele în caz de proliferare necontrolată sau fenotipuri nedorite. Alte strategii includ riguroase testări preclinice de biodistribuție, utilizarea de linii celulare cu risc redus de tumorigenitate și monitorizarea pe termen lung a pacienților.
Se explorează, de asemenea, rute de administrare mai puțin invazive: injecția endovasculară sau livrarea prin cateter ar putea reduce riscurile procedurale comparativ cu implantarea directă parenchimală, însă eficacitatea și țintirea precisă rămân provocări tehnice. Decizia privind utilizarea imunomodulării (de ex. imunosupresie temporară) sau adoptarea de linii HLA-match-uite versus linii universale rămâne una strategică, cu implicări majore atât pentru costuri, cât și pentru fezabilitatea pe scară largă.
Aspecte practice precum producția la scară, crioprezervarea, stabilitatea loturilor, costurile și lanțul de aprovizionare GMP vor modela timpul până la trialurile clinice. De asemenea, definiția clară a criteriilor de includere a pacienților, endpoint-urile de siguranță pentru fazele I și biomarkerii de eficacitate pentru fazele ulterioare vor fi esențiale pentru succesul programelor clinice.
Din punct de vedere etic și reglementator, proiectarea trialurilor va trebui să integreze consimțământ informat detaliat, evaluări riguroase ale raportului risc-beneficiu și planuri de monitorizare pe termen lung pentru a identifica eventualele efecte adverse tardive. Sinergia dintre terapie celulară și programe intensive de reabilitare ar putea spori rezultatele funcționale și merită a fi testată în protocoale combinate.
Expert Insight
„Aceste rezultate oferă dovezi convingătoare că celulele stem neurale pot face mult mai mult decât să înlocuiască neuronii pierduți — ele remodelază mediul local pentru a promova recuperarea vasculară și imună,” spune Dr. Laura Hernandez, specialistă fictivă în neuroreabilitare și neurosciență translatională. „Translatarea acestei abordări la pacienți va necesita măsuri riguroase de siguranță, procese de fabricație scalabile la standarde clinice și metode de administrare bine definite. Totuși, perspectivele de a restabili funcții după un AVC sunt acum mai apropiate decât erau în urmă cu cinci ani.”
Comentariile experților subliniază necesitatea unui efort multidisciplinar: biologi celulari, neurologi, neurochirurgi, ingineri de dispozitive și agenții de reglementare trebuie să colaboreze strâns pentru a transforma dovezile preclinice în terapii sigure și eficiente pentru pacienți.
Concluzie
Studiile conduse sub coordonarea UZH arată că celulele stem neurale umane obținute din iPSC-uri pot supraviețui, se pot diferenția și pot contribui semnificativ la refacerea structurală și funcțională după un AVC experimental la șoareci. Prin combinarea neurogenezei cu repararea vasculară și imunomodularea, transplantul celular a generat îmbunătățiri motorii cuantificabile și schimbări moleculare asociate regenerării.
Lucrările viitoare vor trebui să abordeze pe larg siguranța pe termen lung, stabilitatea produsului și fezabilitatea practică a livrării terapeutice la pacienți. Progrese în protocoale xeno-free, sisteme de siguranță genetică și opțiuni de administrare minim invazive pot accelera tranziția spre trialuri clinice. Dacă aceste obstacole sunt depășite, terapiile cu celule stem neurale pot deveni o opțiune transformatoare pentru restaurarea funcțiilor cerebrale după AVC, completând și îmbunătățind arsenalul actual de intervenții.
În final, următorii pași includ validări în modele animale mari, optimizarea strategiilor de fabricație GMP, definirea endpoint-urilor clinice relevante și inițierea etapelor timpurii ale testării la oameni. Continuarea colaborărilor internaționale și implicarea comunității medicale și a pacienților vor fi decisive pentru a transforma această promisiune științifică într-o terapie aplicabilă în practica clinică.
Sursa: scitechdaily

Lasă un Comentariu