9 Minute
New neural circuit links sleep to body repair
Când dormim, organismul trece în modul de reparare: hormonul de creștere (GH) este eliberat pentru a regenera mușchiul și osul și pentru a regla procesele metabolice. Până de curând, oamenii de știință măsurau GH în probe de sânge recoltate pe parcursul somnului, dar circuitele neurale care declanșează și modulează acea eliberare au rămas neclare. O echipă condusă de UC Berkeley a înregistrat acum activitatea neuronală la șoareci pe parcursul mai multor cicluri somn–veghe și a identificat un circuit care sincronizează secreția de hormon de creștere diferit în timpul somnului REM și al somnului non-REM.
Scientific background and experimental approach
Echipa a folosit înregistrări neuronale continue la șoareci împreună cu teste hormonale pentru a cartografia modul în care populații neuronale specifice se corelează cu pulsațiile de GH. Folosind electrofiziologie continuă, imagistică pe celule și tehnici optogenetice pentru a manipula selectiv tipuri celulare, cercetătorii au urmărit activitatea neuronilor hipotalamici și a nodurilor care influențează trezirea. Au observat modele distincte de reglare a GH în somnul cu mișcări oculare rapide (REM) față de somnul non-REM, indicând o temporalizare fină a impulsurilor endocrine.
Metodologia combinată — măsurători cronofiziologice invasive, sondaje hormonale frecvente și perturbări funcționale prin optogenetică — a permis stabilirea unor corelații temporale foarte precise între aprinderea neuronală și vârfurile de GH. În plus, adoptarea unor protocoale longitudinale, care acoperă cicluri multiple somn–veghe, a ajutat la distingerea modelelor consistente de la cele tranzitorii sau dependente de anumite etape de dezvoltare. Studiul, publicat în Cell în 2025, se bazează pe dovezi de lungă durată că calitatea somnului afectează direct funcția endocrină și sănătatea metabolică.
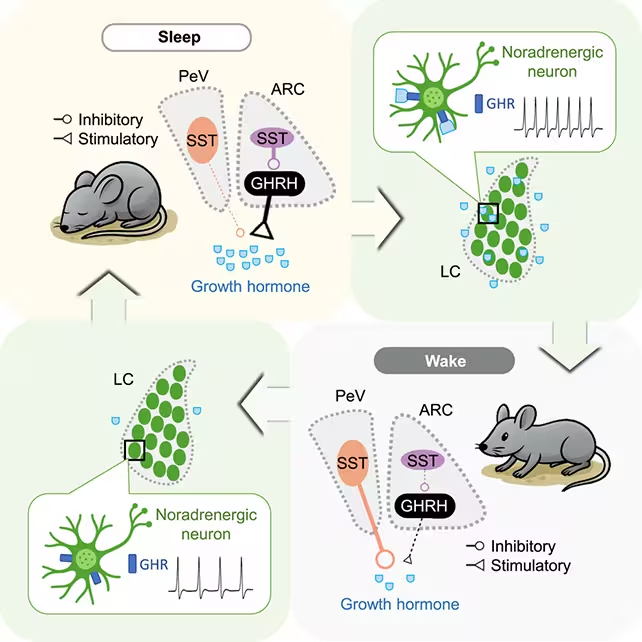
Cercetătorii au analizat eliberarea hormonului de creștere la șoareci în timpul ciclurilor somn/veghe.
Key technical points
- Înregistrările electrophiziologice continue și experimentele optogenetice au permis sincronizarea precisă dintre descărcările neuronale și pulsațiile hormonale GH.
- Studiul a diferențiat neuroni care promovează eliberarea GH de cei care o inhibă, evidențiind schimbări dinamice ale influenței lor între stadiile de somn.
- Este important de remarcat faptul că locus coeruleus — un nucleu al trunchiului cerebral central pentru starea de veghe — a fost identificat ca formând un circuit de feedback cu circuitele care reglează GH.
Main findings and physiological implications
Hormonul de creștere a crescut atât în timpul somnului REM, cât și în non-REM, însă factorii neuronali care determină și suprimă acea eliberare și-au modificat influența relativă în funcție de stadiul somnului. Descoperirea unui circuit reciproc cu locus coeruleus sugerează un sistem fin echilibrat: somnul favorizează secreția de GH, iar GH, la rândul său, poate influența pragurile de excitație asociate stării de veghe. Această buclă de feedback indică faptul că reglarea hormonală nu este izolată, ci integrată cu circuitele neurale care guvernează atenția și vigilența.
Din punct de vedere fiziologic, GH nu este esențial doar pentru creștere și repararea țesuturilor; are un rol important în reglarea glicemiei și a metabolismului lipidic. Eliberarea insuficientă sau incorect temporizată a GH — așa cum apare în somnul fragmentat sau de proastă calitate — este asociată cu un risc crescut de obezitate, rezistență la insulină, diabet de tip 2 și boli cardiovasculare. Astfel, aceste perspective la nivel de circuit conectează neurobiologia de bază a somnului cu reglarea endocrină și cu riscurile pe termen lung pentru sănătatea metabolică.
Mai mult, dinamica pulsatorie a GH — modul în care acest hormon este secretat în vârfuri frecvente — este esențială pentru eficacitatea sa biologică. Studiul sugerează că nu doar cantitatea totală de GH contează, ci și sincronizarea vârfurilor cu stadiile de somn: pulsațiile corect plasate pot favoriza sinteza proteică în perioadele de regenerare, în timp ce deranjarea lor poate altera semnalizarea metabolică chiar dacă valorile medii ale hormonului apar normale la o analiză simplificată. Aceasta oferă o explicație mecanistică pentru observațiile clinice în care pacienții cu somn perturbat prezintă disfuncții metabolice disproporționate față de nivelurile plasmatice aparent normale ale hormonilor.
Potential clinical and research applications
Înțelegerea circuitei neurale care sincronizează eliberarea GH deschide posibilități terapeutice noi. Intervențiile farmacologice țintite sau neuromodularea ar putea restabili ritmurile normale de GH la persoanele cu tulburări de somn sau boli metabolice. Cercetătorii sugerează că locus coeruleus ar putea fi o tinta promițătoare: reducerea excitabilității sale, prin medicamente care scad activitatea noradrenergică sau prin metode de neuromodulare, ar putea reechilibra temporizarea GH și îmbunătăți continuitatea somnului.
Translatarea constatărilor de la șoarece la om va necesita validare suplimentară, dar rolul conservat al structurilor hipotalamice și al trunchiului cerebral în controlul somnului și al sistemului endocrin oferă un traseu plauzibil. Proiecte viitoare ar putea investiga dacă feedback-ul GH–somn modificat contribuie la boli neurodegenerative, cum ar fi boala Alzheimer, în care perturbarea somnului și dereglarea metabolică sunt frecvente. De asemenea, este relevant să se exploreze dacă intervențiile care restabilesc ritmurile GH pot încetini progresia unor afecțiuni neurologice sau pot îmbunătăți recuperarea după leziuni tisulare.
În context clinic imediat, rezultatele sugerează mai multe direcții practice: optimizarea rutinei de somn pentru a favoriza perioadele lungi și nefragmentate de non-REM ar putea ameliora pulsatile GH; testarea ritmurilor hormonale în diagnosticul tulburărilor metabolice ar putea oferi o imagine mai fidelă decât măsurile punctuale; și dezvoltarea unor terapii care vizează circuitele hipotalamo–trunchi cerebrale ar putea completa strategiile dietetice și exercițiile fizice pentru prevenția metabolică.
Expert Insight
"Aceste înregistrări ne oferă o imagine mecanistică despre cum tranzițiile între stadiile de somn controlează pulsațiile hormonale," spune Dr. Elena Martinez, neurocercetătoare în domeniul somnului, neafiliată la studiu. "Dacă circuite similare există și la oameni, există oportunități clare de a rafina tratamente care vizează atât calitatea somnului, cât și sănătatea metabolică — două probleme interconectate în societățile moderne."
Dr. Martinez adaugă că uneltele emergente, precum modularea genetică specifică tipului celular, neurostimularea noninvazivă (de exemplu, stimulare electromagnetică transcraniană și tehnici de neuromodulare focală) și terapiile farmacologice cu acțiune pe canalele ionice sau pe receptorii noradrenergici, ar putea fi folosite pentru a testa dacă ajustarea activității locus coeruleus restabilește ritmurile normale ale hormonului de creștere fără efecte secundare majore. Ea subliniază însă necesitatea unor studii de siguranță și a unor modele preclinice care să evalueze efectele pe termen lung.
Limitations and next steps
Studiul stabilește o bază solidă, dar nu dovedește comportamentul identic al circuitelor la oameni. Sunt necesare studii longitudinale la oameni care să combine polisomnografie detaliată, eșantionare hormonală frecventă și imagistică funcțională sau protocoale de neuromodulare pentru a testa transferabilitatea mecanică a constatărilor. Experimente suplimentare vor trebui să determine modul în care îmbătrânirea, obezitatea, inflamația cronică și neurodegenerarea modifică această buclă somn–GH.
Există, de asemenea, limitări metodologice inerente modelelor animale: pattern-urile de somn la rozătoare au caracteristici distincte față de somnul uman în ceea ce privește distribuția ciclurilor REM/non-REM și raportul dintre perioadele de activitate și repaus. Prin urmare, calibrarea interpretărilor pentru contextul clinic uman necesită prudență. Totodată, intervențiile optogenetice frecvent folosite la șoareci nu sunt direct translatabile la terapii umane fără dezvoltarea unor vectori siguri și strategii de livrare celulare țintite.
Următorii pași includ identificarea mai precisă a populațiilor neuronale hipotalamice implicate — de exemplu, neuroni care secreta GHRH (hormon de eliberare a GH) versus neuroni somatostatinergici care inhibă GH — și cum interacționează aceștia cu proiecțiile noradrenergice ale locus coeruleus. Analizele moleculare și transcriptomice pot ajuta la definirea markerilor celulari utili pentru țintire terapeutică. Proiectele clinice ar trebui să includă biomarkeri metabolici și măsuri funcționale, cum ar fi toleranța la glucoză și profilul lipidic, pentru a evalua relevanța practică a restabilirii ritmurilor GH.
Conclusion
Această cercetare cartografiază un circuit neural care sincronizează eliberarea hormonului de creștere în funcție de stadiile de somn și identifică locus coeruleus ca un nod de feedback care leagă semnalizarea endocrină de starea de veghe. Prin evidențierea modului în care somnul REM și non-REM angajează în mod diferit promotori și inhibitori ai GH, studiul face legătura între fiziologia somnului și sănătatea metabolică. Investigațiile continue ar putea conduce la terapii țintite pentru tulburările de somn, bolile metabolice și afecțiunile asociate cu dereglări ale somnului și echilibrului hormonal.
Pe măsură ce domeniul avansează, integrarea datelor preclinice cu studii clinice riguroase și cu progrese în tehnologiile de neuromodulare și biologie celulară va fi esențială. Aceasta va permite nu doar confirmarea validității circuitelor descrise la oameni, ci și dezvoltarea unor strategii terapeutice cu potențial real de a îmbunătăți sănătatea metabolică și calitatea vieții prin optimizarea somnului și a ritmurilor hormonale naturale.
Sursa: sciencealert


Lasă un Comentariu