8 Minute
Oamenii adesea atribuie uitarea simplului fapt că „doar îmbătrânesc”. Dar ce-ar fi dacă îmbătrânirea este mai puțin un singur vinovat și mai mult un cor de schimbări lente, care interacționează în tot creierul?
Cercetătorii coordonați de Universitatea din Oslo au dus această întrebare dincolo de anecdote prin reunirea unei colecții masive de date clinice: mii de voluntari sănătoși, peste 10.000 de scanări RMN și mult peste 13.000 de teste cognitive. Rezultatul este una dintre cele mai clare și detaliate imagini de până acum despre cum se leagă, de-a lungul decadelor, modificările structurale ale creierului de memoria episodică — acea facultate care ne permite să ne amintim evenimente, locuri și momente.
Studiul și datele
Analiza a combinat înregistrările a 3.737 de participanți cognitiv sănătoși urmăriți în cadrul mai multor cohorturi de cercetare de lungă durată. Această scară contează: studiile mici pot sugera modele; acesta unește zeci de cohorturi pentru a dezvălui modul în care anatomia cerebrală și performanța memoriei co-evoluează pe parcursul vieții adulte.
Metodologic, proiectul s-a bazat pe date longitudinale — adică pe măsurători repetate la aceiași participanți — ceea ce permite să se distingă schimbările reale în timp de variația între indivizi. Scanările RMN au fost folosite pentru a estima volume regionale, grosimea corticală și alte măsuri structurale; testele cognitive au acoperit memoria episodică cu sarcini standardizate de amintire a listelor, recunoaștere și rememorare contextuală. Controlul pentru variabile demografice, educație și apariția condițiilor medicale cronice a fost esențial pentru a interpreta corelațiile observate.
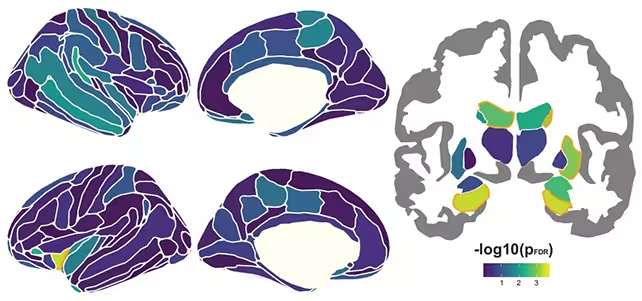
Nu este surprinzător că hipocampul — cunoscut de mult timp ca un centru al memoriei episodice — s-a evidențiat printre regiuni. Totuși, titlul nu ar trebui să fie „doar hipocampul”. Atrofia în multiple regiuni cerebrale a corelat cu o memorie episodică mai slabă, iar aceste corelații s-au întărit pe măsură ce vârsta a avansat. Cu alte cuvinte, pierderea de volum cerebral devine mai consecventă pentru memoria practică după aproximativ 60 de ani, iar modificările în multe regiuni, nu un singur punct fierbinte, definesc declinul.
Genetica joacă, de asemenea, un rol important. Purătorii alelei APOE ε4 — o variantă asociată cu un risc mai mare de boala Alzheimer — au prezentat, în medie, pierdere de țesut mai rapidă și un declin mai abrupt al memoriei. Cu toate acestea, traiectoria generală pe întregul eșantion a fost consecventă: aceleași procese anatomice par să fie la lucru, doar accelerate în purtătorii APOE ε4. După cum a remarcat neurologul Alvaro Pascual-Leone, „Prin integrarea datelor din zeci de cohorturi de cercetare, avem acum cea mai detaliată imagine de până acum asupra modului în care se desfășoară modificările structurale ale creierului odată cu vârsta și cum se raportează acestea la memorie.”
Importanța acestui efort de mare proporție este multiplă: oferă putere statistică pentru a detecta efecte mici dar consistente, ajută la replicarea rezultatelor între populații diferite și permite studii subgrup, de exemplu compararea efectelor pe sexe, pe tranșe de vârstă sau în funcție de factorii de risc vasculari.
Anatomia declinului și ce înseamnă
Deci ce concluzii practice putem trage? În primul rând, pierderea memoriei în viața târzie rar este produsul eșecului izolat al unei singure regiuni. Ea reflectă o vulnerabilitate biologică extinsă: un tipar de atrofie graduală care se acumulează pe decenii. În al doilea rând, momentul în care apar schimbările contează. Același grad de mică contracție regională pare să aibă mai multă semnificație după mijlocul vieții, ceea ce sugerează că pierderile mici timpurii pot declanșa consecințe funcționale mai mari mai târziu.
Mecanismele biologice implicate sunt multiple și interconectate:
- Atrofia hipocampală și reducerea grosimii corticale în lobii temporali și parietali afectează procesele de codificare și recuperare a amintirilor.
- Modificări ale substanței albe și hiperintensități vasculare pot perturba conectivitatea între rețelele cerebrale implicate în memorie.
- Inflamația cronică, disfuncția mitocondrială și pierderea sinaptică contribuie la deteriorarea funcțională chiar înainte de pierderea vizibilă a volumului.
- Factorii vasculari — hipertensiune, ateroscleroză mică — pot amplifica efectele atrofiei, implicând un mecanism vascular-cerebral în declinul cognitiv.
Aceste constatări au consecințe practice pentru cercetare și terapie. Tratamentele orientate spre păstrarea memoriei sunt puțin probabil să aibă succes dacă vizează doar o singură structură. Intervențiile eficiente vor trebui probabil să abordeze rețele cerebrale multiple — protejând țesutul, susținând sănătatea sinaptică și reducând inflamația sau leziunile vasculare atunci când este cazul. Autorii studiului sugerează că intervenția timpurie va fi mai benefică decât așteptarea până când apare un declin cognitiv evident.
Există, totuși, un aspect încurajator. Deoarece pattern-urile sunt larg împărtășite între persoanele cu și fără APOE ε4, multe strategii terapeutice ar putea fi utile ambelor grupuri. Cu alte cuvinte: aceleași mecanisme de bază par a fi la lucru, doar cu viteze diferite.
Din perspectivă clinică, acest lucru înseamnă că măsurile de reducere a riscului vascular (controlul tensiunii arteriale, gestionarea diabetului), promovarea exercițiului fizic regulat, optimizarea somnului și strategiile de stimulare cognitivă nu sunt doar recomandări generale — ele ar putea influența direct traiectoria atrofiei și, implicit, a memoriei episodice.
Direcții viitoare și instrumente
Seturile mari de date RMN, precum cel folosit în acest studiu, reprezintă o resursă prețioasă pentru modelele predictive ale îmbătrânirii cognitive. Instrumentele de învățare automată, combinate cu imagistică longitudinală și testare repetată a memoriei, ar putea ajuta la identificarea persoanelor cu risc crescut cu ani înainte de apariția simptomelor clinice. Aceasta deschide calea către prevenția de precizie — strategii de stil de viață sau farmacologice personalizate, adaptate traiectoriei anatomice a fiecărei persoane.
Tehnic, următoarele direcții sunt promițătoare:
- Modele multimodale care combină RMN structural cu imagistică funcțională, PET pentru proteine patologice (unde este disponibilă) și biomarkeri periferici pentru inflamație sau disfuncție metabolică.
- Algoritmi de învățare profundă și modele explicabile (explainable AI) care pot identifica tipare predictibile dar interpretabile clinic.
- Studii intervenționale timpurii care să testeze dacă modificarea factorilor de risc vascular, intervențiile antiinflamatorii sau terapiile de neuroprotecție pot schimba panta declinului.
Încă rămân întrebări cheie. Ce determină variația între indivizi? În ce măsură sănătatea vasculară, inflamația, stilul de viață și educația se intersectează cu genetica pentru a modela aceste traiectorii cerebrale? Și, esențial: ce intervenții modifică cu adevărat panta declinului, nu doar simptomele?
Răspunsul la aceste întrebări necesită studii controlate, cohorte diversificate din punct de vedere geografic și etnic, și o colaborare strânsă între neuroimagistică, epidemiologie, genetică și științele comportamentale. Datele deschise și metaanalizele coordonate pot accelera progresul, permițând replicarea și generalizarea constatărilor.
Perspective ale experților
Dr. Maya Reynolds, neurocercetătoare cognitivă și specialistă în îmbătrânire, comentează: „Acest tip de muncă integrativă redefinește modul în care gândim despre pierderea memoriei. Nu este un eșec izolat, ci o vulnerabilitate la nivel de sistem. Aceasta ne mută atenția de la medicamente cu țintă unică spre strategii multidimensionale — de la controlul riscului vascular și exerciții fizice la sănătatea somnului și neuroprotecție țintită. Evaluarea timpurie și intervențiile susținute ar putea face o diferență reală peste decenii.”
Ceea ce sugerează această perspectivă este un cadru pragmatic pentru intervenție: detectați devreme, tratați pe mai multe fronturi și adaptați eforturile la profilul individual de risc. În practică, asta poate însemna implementarea programelor de screening pentru factori de risc vasculari și cognitivi la vârstele mijlocii, integrarea recomandărilor de sănătate cerebrală în îngrijirea primară și dezvoltarea unor terapii combinatorii care să vizeze atât aspectele vasculare, cât și cele neurodegenerative.
Pe termen lung, speranța este ca procesul de îmbătrânire să fie mai degrabă gestionat decât perceput ca o alunecare inevitabilă în uitare. Prin investigații continue ale căilor biologice care stau la baza atrofiei cerebrale și declinului memoriei episodice, calea către intervenții eficiente devine mai clară: depistare timpurie, tratamente cu spectru larg și personalizare în funcție de riscul fiecărei persoane. Acest set de abordări are potențialul de a întârzia semnificativ debutul deficitelor cognitive și de a îmbunătăți calitatea vieții pentru milioane de oameni.
Sursa: sciencealert


Lasă un Comentariu