8 Minute
Invizibile și la scară nanometrică, bulele eliberate de celule devin jucători-cheie în modul în care cancerul se răspândește în organism. Recreând în laborator acești mici mesageri, cercetătorii speră atât să cartografieze metastaza, cât și să livreze medicamente mai precis la tumori — cu potenţialul de a opri evoluția cancerului.
Ce sunt aceste bule microscopice și de ce contează
Fiecare celulă secretă vezicule extracelulare — particule învelite într-o membrană, adesea sub 100 nanometri, care transportă lipide, proteine și fragmente de material genetic. În biologia sănătoasă, ele mediază comunicarea între celule. În cancer, însă, aceste vezicule pot funcționa ca curieri secreți care pregătesc țesuturi îndepărtate, remodelează micromediile și chiar resetează celule sănătoase astfel încât să susțină creșterea tumorală. Această cascadă de evenimente este centrală în metastază, procesul prin care cancerul se extinde dintr-un tumoare primară către organe cum sunt ficatul sau plămânii.
Înțelegerea compoziției și a traseului acestor vezicule este esențială pentru a elucida mecanismele metastatice și pentru a dezvolta strategii terapeutice eficiente. Izolarea și caracterizarea veziculelor extracelulare naturale din sânge sau țesut sunt însă proceduri lente, tehnic complexe și supuse variabilității biologice. Acest blocaj metodologic a determinat echipe din bioinginerie și biologie oncologică să se orienteze spre analoage sintetice: liposomi și alte nanoparticule lipidice care mimează forma și funcția veziculelor naturale.
Cum recreează cercetătorii mesagerii produși de cancer
La École de technologie supérieure (ÉTS), un grup interdisciplinar condus de ingineri produce liposomi utilizând micromixere — dispozitive microfluidice care combină rapid soluții de lipide, proteine, soluții apoase și alcoolice pentru a forma nanoparticule uniforme. Prin reglarea raportului de lipide, a sarcinii de suprafață și a conținutului proteic, laboratorul obține particule care seamănă cu veziculele extracelulare ca dimensiune și comportament.
Veziculele artificiale sunt marcate cu coloranți fluorescenți, sunt incubate cu celule canceroase cultivate și filmate în timp real. Experimentele urmăresc viteza și proporția populației de nanoparticule preluate de celule, precum și caracteristicile biochimice care favorizează internalizarea. Pe scurt, cu cât dimensiunea, sarcina și proteinele de la suprafață ale unui liposom se apropie mai mult de cele ale veziculei naturale, cu atât o celulă cancerigenă este mai predispusă să îl absoarbă.
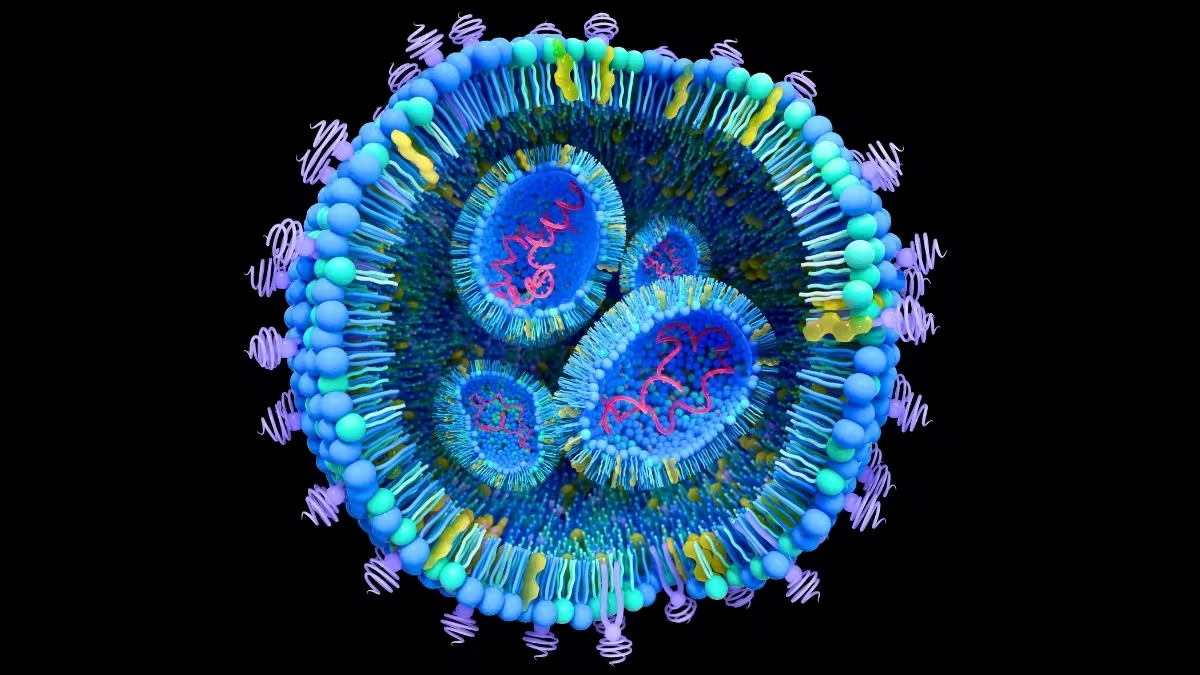
Asemănarea de fidelitate contează din două motive. În primul rând, o mimicrie fidelă ajută oamenii de știință să cartografieze modul în care veziculele derivate din tumori călătoresc către organe specifice și ce semnale livrează celulelor rezidente. În al doilea rând, deschide o cale pentru a folosi aceiași curieri ca vehicule pentru livrarea țintită a medicamentelor — transformând o cale patologică într-o platformă de administrare terapeutică.
De la modele de laborator la idei terapeutice
Lucrările actuale au atins o eficiență de aproximativ 50% în încapsularea proteinelor în liposomi fabricați în laborator; obiectivul echipei este de a apropia această eficiență de 90% pentru a oglindi mai bine veziculele extracelulare naturale. Odată ce parametrii de formulare sunt rafinați, protocolul trece de la culturi celulare la modele animale — sunt planificate studii pe șobolani pentru a valida transportul și livrarea de încărcături terapeutice in vivo.
Există mai multe strategii terapeutice în explorare. Una este încărcarea liposomilor cu chimioterapice consacrate, precum paclitaxelul, care deja a demonstrat o livrare îmbunătățită și tolerabilitate mai bună când este formulat în purtători lipidici. O altă abordare este încapsularea compușilor naturali biologic activi: curcumina (din turmeric) și molecule înrudite au arătat efecte antiinflamatorii și antiproliferative în numeroase studii, iar ambalarea curcuminei în liposomi îi crește biodisponibilitatea și potențialul de orientare către tumori.
Dincolo de molecule mici, liposomii pot transporta acizi nucleici sau anticorpi. Fragmente scurte de ADN, siRNA sau fragmente de anticorpi pot fi ferry-uite către tumori pentru a tăcea oncogene, a sensibiliza celulele canceroase la medicamente sau a marca celulele maligne pentru eliminare imună. Aceste abordări multimodale sunt deja parte din trusa tot mai extinsă a nanomedicinei și au ajuns în utilizare clinică în anumite contexte, în special în terapiile oncologice de ultimă generație.
În practică, dezvoltarea acestor formulări implică optimizări multiple: stabilitatea liposomilor în circulație, eliberarea controlată a încărcăturii, evitarea capturii rapide de către sistemul reticuloendotelial și compatibilitatea imună. De asemenea, integrarea markerilor direcționali la suprafață (de exemplu peptide sau antigene specifice) poate conduce la o selectivitate crescută față de nișele metastatice.
Ce dezvăluie experimentele
Imagistica în timp real indică faptul că dimensiunea particulelor și chimia suprafeței sunt determinanți primari ai captării. Particulele care replică diametrul și profilul electrostatic al veziculelor naturale sunt internalizate mai eficient de celulele hepatice canceroase in vitro, sugerând că metastaza specifică unor organe poate fi mediată, în parte, de identitatea fizică a veziculelor aflate în circulație.
Această observație reformulează o întrebare de lungă durată în cercetarea metastazelor: țintirea organelor este condusă în principal de semnalele moleculare secretate de tumori sau sistemele fizice de livrare — adică veziculele în sine — joacă un rol selectiv? Răspunsul pare a fi unul combinat. Mărfurile biochimice instructează țesutul țintă, în timp ce atributele fizice ale veziculei determină dacă ajunge acolo în cantitate suficientă pentru a declanșa un efect biologic.
Mai mult, experimentele au arătat că anumite proteine de la suprafață (receptori, integrine) și lipide specifice pot direcționa tropismul organizațional al veziculelor. Înțelegerea acestor semnale oferă oportunități pentru a proiecta liposomi cu tropism controlat, o componentă cheie pentru terapiile țintite și pentru diagnosticul molecular al riscului metastatic.
Implicații clinice potențiale
- Prevenirea metastazei: Dacă pregătirea organelor la distanță mediată de vezicule poate fi blocată, metastazele s-ar putea să nu reușească să se stabilească. Decoy-uri pe bază de liposomi sau inhibitori pot intercepta veziculele nocive înainte ca acestea să acționeze.
- Tratament țintit: Liposomii proiectați pentru a imita veziculele tumorale pot livra medicamente citotoxice sau terapii genice selectiv către nișele metastatice, reducând toxicitatea sistemică.
- Biomarkeri și diagnostice: Caracterizarea compoziției veziculelor din sânge poate oferi semnale timpurii privind riscul de metastază sau răspunsul la terapie, facilitând decizii clinice personalizate.
Aceste obiective sunt realizabile și nu doar vise îndepărtate. Mai multe nanoformulări sunt deja utilizate clinic, iar studiile în curs rafinează designul particulelor pentru a crește specificitatea, a reduce captarea imună și a optimiza eliberarea încărcăturii. Integrarea tehnicilor avansate de secvențiere a ARN-ului vezicular, proteomică și analiza lipidomică poate genera panouri de biomarkeri cu valoare prognostică și predictivă.
Perspectiva expertă
"Reproducerea pachetelor de comunicare proprii organismului ne oferă atât un microscop, cât și o hartă," spune Dr. Elena Marquez, o ingineră biomedicală fictivă care studiază nanotransportorii. "Când un liposom fabricat în laborator se comportă ca o veziculă derivată din cancer, putem observa traseul de livrare și apoi proiecta intervenții care fie blochează semnalele dăunătoare, fie folosesc aceeași cale pentru a livra terapii extrem de țintite."
Această perspectivă subliniază valoarea duală a abordării: aprofundarea cunoașterii fundamentale despre metastază în paralel cu accelerarea terapiilor translationale. În plus, colaborările interdisciplinare între inginerie, biologie, farmacologie și științe clinice sunt esențiale pentru a trece de la dovezi preclinice la aplicabilitate medicală reală.
Provocări și pași următori
Rămân obstacole majore. Scalarea producției de particule uniforme, asigurarea unei încapsulări proteice stabile, evitarea eliminării rapide de către sistemul imunitar și validarea siguranței în modele animale sunt domenii active de cercetare. Căile de reglementare pentru hibrizi complexi biologic–nanoparticulă sunt, de asemenea, în curs de dezvoltare, ceea ce poate încetini traducerea clinică.
Totuși, rezultatele incrementale raportate de echipe interdisciplinare converg către o concluzie clară: veziculele extracelulare nu sunt doar epifenomene ale bolii, ci agenți activi în progresia cancerului. Și prin copierea lor, cercetătorii pot obține pârghiile necesare pentru a preveni sau trata metastaza mai eficient. Strategii precum optimizarea lipidelor constitutive pentru stabilitate, adăugarea de molecule „stealth” (de ex. PEGilare) pentru a reduce clearance-ul și adaptarea ligandilor de suprafață pentru direcționare sunt direcții concrete de dezvoltare.
Trecerea de la culturile celulare la modele animale constituie reperele critice pe termen scurt pentru colaborarea ÉTS–McGill. Dacă studiile pe animale vor demonstra transportul eficient și siguranța încărcăturilor terapeutice, acestea pot deschide calea pentru studii clinice în oameni cu liposomi intercepționali și sisteme de livrare direcționate — tehnologii care pot schimba prognosticul pacienților cu risc crescut de boală metastatică.
Pe măsură ce cercetarea avansează, este esențială o comunicare clară între cercetători, clinicieni, reglementatori și pacienți, pentru a asigura că dezvoltările în nanomedicină sunt aplicate în mod etic, sigur și eficient. Îmbinarea datelor mecanistice cu dovezi preclinice robuste va fi cheia pentru a transforma aceste promisiuni într-un impact clinic real.
Sursa: sciencealert

Lasă un Comentariu