8 Minute
Cercetătorii au descoperit o conexiune genetică comună care leagă opt tulburări psihiatrice majore, dezvăluind modul în care anumite variante genelor acționează pe parcursul dezvoltării cerebrale și pot influența multiple afecțiuni. Noile rezultate indică că există căi moleculare împărtășite care ar putea deveni ținte pentru terapii capabile să abordeze mai multe boli simultan.
Semnale genetice comune în opt afecțiuni
Într-un tablou în continuă extindere al geneticii psihiatrice, o echipă din Statele Unite a construit pe baza unor studii internaționale anterioare pentru a cartografia modul în care aceleași gene contribuie la diagnostice variate. Încă din 2019, cercetătorii identificaseră 109 gene care apăreau în combinații diferite în cazuri de autism, ADHD, schizofrenie, tulburare bipolară, tulburare depresivă majoră, sindrom Tourette, tulburare obsesiv-compulsivă și anorexie. Această suprapunere a oferit o explicație biologică plauzibilă pentru faptul că aceste condiții apar frecvent concomitent în cadrul acelorași persoane sau familii.
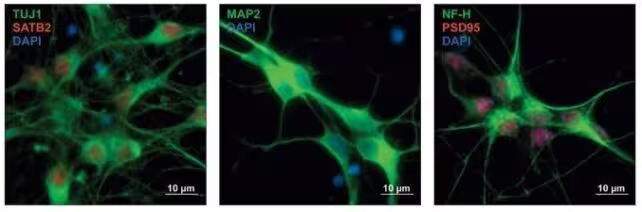
Neuronii precursori umani cu expresie proteică colorată în nuanțe diferite, indicând tipul neuronilor în dezvoltare.
Studiul recent, publicat în Cell la începutul anului 2025, a mers mai departe. În loc să se limiteze la o listă de gene implicate, investigatori au testat aproape 18.000 de variante genetice extrase atât din setul comun de gene, cât și din gene specifice fiecărei tulburări. Cercetătorii au introdus aceste variante în celule precursor neuronale umane pentru a observa efectele asupra reglării genelor în ferestre critice ale dezvoltării cerebrale.
Abordarea aceasta funcționează la intersecția dintre genetică, biologie celulară și neurodezvoltare: în loc să se asocieze o singură genă cu o singură boală, s-a investigat cum variantele regulate afectează rețele de transcriere și semnalizare în etape temporale specifice (de exemplu, diferențierea neuronală timpurie versus maturarea sinaptică târzie). Aceasta oferă o perspectivă mai dinamică asupra arhitecturii genetice a tulburărilor psihiatrice.
Metode care dezvăluie când și cum acționează genele
Pentru a determina care variante modifică efectiv activitatea regulatorie, echipa a folosit combinații de tehnici moleculare și funcționale. Au modelat activitatea variantelor în neuroni umani în dezvoltare și apoi au validat observațiile în neuroni de șoarece în curs de dezvoltare, pentru a testa conservarea efectelor corelate evolutiv.
Prin această abordare multi-sistem, au identificat 683 de variante care modifică măsurabil activitatea regulatorie. Aceste variante au fost testate în contexte experimentale care măsoară expresia promotoarelor sau a elementelor de tip enhancers, folosind tehnologii avansate de tip high-throughput (de exemplu, teste reporter masive și analize de tip MPRA—assay reporter masiv paralel), precum și secvențiere transcriptomică pentru a urmări schimbările în expresia genelor țintă.
Un rezultat important a fost constatarea că multe dintre aceste modificări sunt pleiotrope: o singură variantă influențează mai multe trăsături sau condiții. Variantele pleiotrope nu doar că au fost active într-o gamă mai largă de tipuri celulare din creier, dar au și interacționat mult mai frecvent cu alte proteine în rețelele proteină–proteină (PPI) comparativ cu variantele specifice unei singure tulburări.
Ce înseamnă pleiotropia în acest context
Pleiotropia — fenomenul prin care o singură schimbare genetică afectează mai multe procese biologice — ajută la explicarea suprapunerii simptomelor și a co-apariției diagnostice. "Proteinele produse de aceste gene sunt, de asemenea, foarte conectate cu alte proteine", a explicat geneticianul Hyejung Won de la University of North Carolina. "Modificările acestor proteine, în special, pot produce unde de influență în rețea, cauzând efecte la scară largă în creier."
Această perspectivă de rețea este critică deoarece multe variante pleiotrope rămân active pe ferestre de dezvoltare extinse, influențând posibile cascade de reglare genică de la diferențierea neuronală timpurie până la maturarea ulterioară. Din punct de vedere practic, o singură variantă poate modula mai multe etape de dezvoltare și tipuri celulare, generând rezultate clinice diverse în funcție de momentul și contextul activării (de exemplu, impact diferit dacă efectul apare în progenitori neuronali timpurii față de neuroni corticali maturi).
Mai mult, conectivitatea ridicată a proteinelor codificate de genele pleiotrope sugerează că aceste variante pot amplifica perturbările biologice: o mică modificare în expresia sau funcția unei proteine nucleare sau a unui factor de transcripție poate avea consecințe largi prin perturbarea complexelor proteice și a rutelor de semnalizare sinaptică.
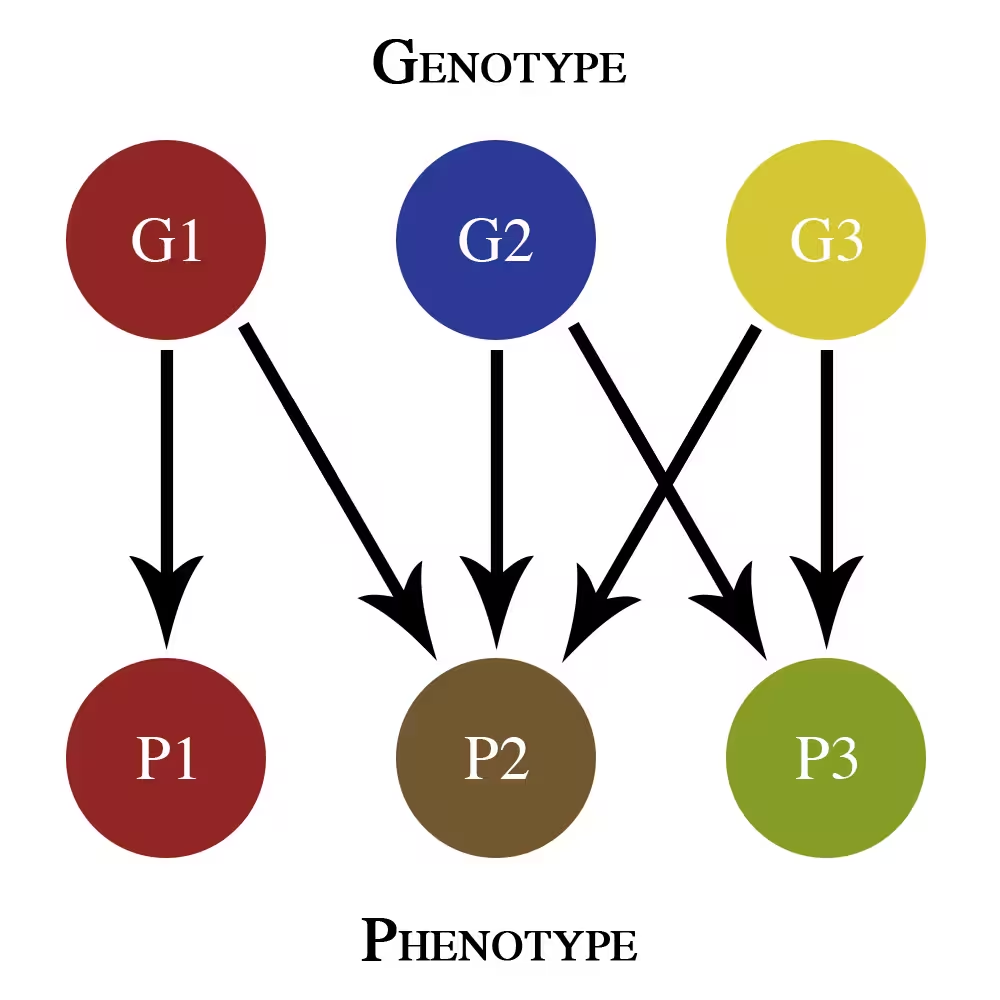
Această hartă simplă genotip–fenotip arată doar efecte pleiotrope aditive. G1, G2 și G3 sunt gene diferite care contribuie la trăsături fenotipice P1, P2 și P3.
Din punct de vedere metodologic, detectarea acestor variante activate temporar implică integrarea datelor epigenomice (de exemplu, semne histonice și accesibilitate cromatină), transcriptomice și funcționale. Identificarea momentului exact în care o variantă afectează expresia — „ferestra temporală”— permite cercetătorilor să coreleze efectele moleculare cu faze specifice ale maturării neuronale și cu fenotipuri clinice observabile.
De ce această descoperire poate schimba strategiile terapeutice
Înțelegerea arhitecturii genetice comune schimbă felul în care oamenii de știință gândesc diagnosticul și terapia. "Pleiotropia a fost privită tradițional ca o provocare deoarece complică clasificarea tulburărilor psihiatrice", a spus Won. "Totuși, dacă putem înțelege baza genetică a pleiotropiei, s-ar putea dezvolta tratamente care vizează acești factori genetici comuni, ceea ce ar putea ajuta la tratarea mai multor tulburări psihiatrice cu o terapie comună."
Miza pentru sănătatea publică este ridicată: Organizația Mondială a Sănătății estimează că aproximativ unul din opt oameni — aproape un miliard în întreaga lume — trăiesc cu o formă de tulburare psihiatrică. Dacă terapiile pot viza noduri centrale în rețele de proteine sau cascade regulatorii comune, în teorie acestea ar putea reduce povara simptomatică transdiagnostic, în loc să trateze fiecare afecțiune ca pe o entitate complet separată.
Există mai multe direcții concrete în care aceste descoperiri pot influența cercetarea și dezvoltarea clinică:
- Prioritizarea variantelor regulatorii pleiotrope pentru studii funcționale și modele animale; aceste variante pot fi candidate pentru terapii farmacologice sau intervenții de tip terapie genică.
- Maparea activității temporale a acestor variante în creierul în dezvoltare, pentru a identifica perioade sensibile în care intervenția ar fi cea mai eficientă.
- Testarea în modele preclinice dacă modularea căilor comune reduce riscul sau severitatea mai multor tulburări simultan.
- Dezvoltarea de biomarkeri moleculare și imagistici funcționale care reflectă perturbările rețelelor identificate pentru a ghida terapiile personalizate.
Pe lângă implicațiile terapeutice, studiul oferă o foaie de parcurs pentru munca viitoare: prioritizarea variantelor regulatorii pleiotrope, cartografierea activității lor temporale în creierul în dezvoltare și testarea dacă intervenția asupra căilor comune modifică riscul pentru mai multe tulburări deodată. Aceasta reprezintă un pas semnificativ către o abordare integrată a geneticii psihice care unește tehnicile omice, modelele celulare și validarea funcțională.
În termeni mai largi, această linie de cercetare subliniază necesitatea unei perspective de sistem asupra bolilor mentale: mai degrabă decât o hartă statică a genei–bolii, rezultatele sugerează un grafic dinamic axat pe rețele, timp și tip celular. Pentru clinicieni și dezvoltatorii de medicamente, aceasta implică proiectarea de intervenții care să fie sensibile la momentul dezvoltării și la impactul sistemic al moleculelor țintă.
În concluzie, deși traducerea descoperirilor genetice în terapii sigure și eficiente rămâne o provocare, identificarea variantelor pleiotrope și a rețelelor pe care le afectează constituie un fundament științific robust pentru strategii de tratament mai larg aplicabile. Studiul publicat în Cell reprezintă un pas important către o abordare integrată, transdiagnostică a tulburărilor psihiatrice, cu potențialul de a transforma modul în care definim, diagnosticăm și tratăm aceste afecțiuni.
Pentru cititorii interesați de termeni-cheie și concepte legate de acest subiect, câteva expresii esențiale în limba română care apar în text: genetică psihiatrică, variantă genetică, pleiotropie, dezvoltare cerebrală, reglare genică, rețea proteină–proteină, terapii țintite, marker biologic. Aceste cuvinte pot ajuta la căutări ulterioare de literatură științifică sau resurse clinice.
Notă: raportul menționat reflectă rezultatele unei cercetări recente și sintetizează concluzii generale; detaliile experimentale specifice și datele brute sunt publicate în articolul original din Cell (2025). Organizații internaționale precum WHO continuă să furnizeze estimări privind povara globală a bolilor mintale, care pot fi consultate pentru cifre actualizate.
Sursa: sciencealert

Lasă un Comentariu