8 Minute
Cercetători din Japonia raportează că niveluri crescute ale unei proteine mitocondriale numite COX7RP îmbunătățesc producția de energie celulară, încetinesc semnele îmbătrânirii și adaugă aproximativ 6,6% la durata medie de viață a șoarecilor masculi. Lucrarea leagă o organizare mitocondrială mai bună de un metabolism optimizat și de rezistență fizică crescută, sugerând strategii noi pentru promovarea healthspan-ului (perioada de viață sănătoasă).
Supercomplexele mitocondriale și rolul COX7RP
Mitocondriile sunt frecvent descrise ca „bateriile” celulelor; complexe respiratorii individuale se asamblează în unități mai mari, denumite supercomplexe, pentru a funcționa cu o eficiență crescută. Proteina COX7RP acționează ca un stabilizator pentru aceste asamblări, contribuind la menținerea arhitecturii necesare pentru fosforilarea oxidativă eficientă. În studiul recent condus de cercetători de la Saitama Medical University și Chiba University, șoarecii au fost modificați genetic pentru a exprima cantități mai mari de COX7RP; echipa a monitorizat ulterior parametri metabolici, markeri moleculari și durata de viață.
Lucrările de laborator au inclus analize biochimice și morfologice pentru a evalua capacitatea mitocondriilor de a forma supercomplexe și de a genera ATP. Tehnici precum electroforeza în condiții native (blue-native PAGE), măsurarea ratei consumului de oxigen (OCR) la nivel de izolate mitocondriale și teste de producere a speciilor reactive de oxigen (ROS) au oferit dovezi că supraexprimarea COX7RP favorizează o rearanjare structurală benefică. Aceste schimbări structurale au dus la o producție energetică mai eficientă și la o reducere a emisiilor de ROS, compuși care, în timp, pot deteriora componente celulare și accelera procesele de îmbătrânire.
Ce s-a schimbat la șoarecii modificați
Șoarecii masculi cu expresie crescută de COX7RP au trăit, în medie, cu aproximativ 6,6% mai mult decât animalele martor. Mai important, aceștia au prezentat markeri concludenți de îmbunătățire a healthspan-ului: toleranță la glucoză mai bună, niveluri mai scăzute ale acizilor grași liberi circulanți și o rezistență musculară superioară la teste de efort. Aceste trăsături contribuie la menținerea mobilității și a stabilității metabolice odată cu înaintarea în vârstă.
Din punct de vedere molecular, s-au observat modificări favorabile în biomarkeri asociați îmbătrânirii: semne ale stresului celular redus, activitate mitocondrială îmbunătățită și o expresie schimbată a unor gene implicate în homeostazia energetică. Datele sugerează o legătură coerentă între arhitectura supercomplexelor mitocondriale, eficiența fosforilării oxidative și parametrii fenotipici asociați longevității și performanței fizice.
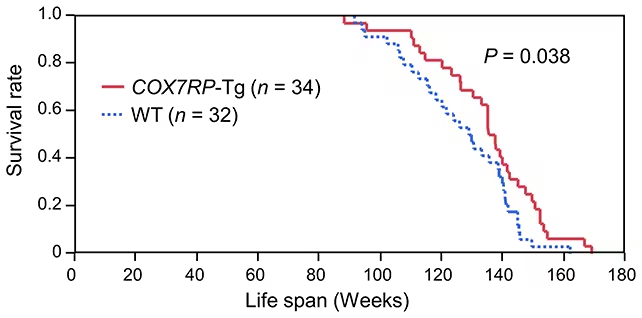
Șoarecii modificați genetic au trăit mai mult.
Context științific și implicații
Dezvăluirile recente se încadrează într-un corp vast de literatură care asociază declinul mitocondrial cu boli cronice ale vârstei, precum demența, sindromul metabolic și rezistența la insulină. Multe intervenții care extind durata de viață în modele experimentale vizează procese specifice de boală sau pathway-uri metabolice (de exemplu, restricția calorică, inhibitori de mTOR sau activatori SIRT). Dovezile directe că îmbunătățirea structurii mitocondriale singure poate influența atât longevitatea, cât și healthspan-ul în absența unei boli primare sunt mai rare; acest studiu adaugă un suport experimental direct pentru această ipoteză.
Autorii propun că intervențiile care favorizează asamblarea sau stabilitatea supercomplexelor respiratorii mitocondriale ar putea deveni direcții terapeutice promițătoare. Printre opțiuni se numără molecule de mică greutate care influențează stabilitatea scaffold-urilor proteice, suplimente metabolice care optimizează fosforilarea oxidativă, biologice țintite care cresc activitatea COX7RP sau chiar strategii genetice pentru a mări expresia proteinei în țesuturile cele mai afectate de îmbătrânire, cum ar fi mușchiul scheletic și țesutul nervos periferic.
Din perspectiva farmacologică, dezvoltarea unor mici molecule care să se lege la interfețele dintre subunitățile complexelor respiratorii sau la interacțiuni proteice specifice ar putea mima efectele COX7RP, fără a necesita modificări genetice permanente. În paralel, tehnici moderne de livrare genetică — de exemplu vectori AAV direcționați — ar putea fi testate pentru a crește expresia COX7RP în mod selectiv în organele țintă. Fiecare abordare ridică întrebări despre eficiență, specificitate tisulară și siguranță pe termen lung.
Limitări și pașii următori
Rezultatele la rozătoare sunt încurajatoare, însă traducerea lor la om rămâne incertă. Diferențele fundamentale în longevitate, fiziologie și complexitatea îmbătrânirii umane înseamnă că descoperirile în modele animale reprezintă un prim pas, nu o garanție. Există, de asemenea, riscul ca supraexpresia unei proteine mitocondriale să producă efecte secundare neprevăzute, inclusiv perturbări în reglarea redox, modificări metabolice compensatorii sau răspunsuri imune la terapii genetice.
Pentru a avansa spre aplicații clinice, este necesară o serie de investigații: studii de toxicitate pe termen lung, evaluarea efectelor în ambele sexe și în variante genetice diferite, identificarea metodelor optime de livrare (moleculă mică, peptide, biologice sau vectori genetici) și determinarea fenotipurilor clinice relevante care ar reflecta beneficiul terapeutic la om. De asemenea, este importantă validarea acestor mecanisme în țesuturi umane izolate și în modele preclinice de complexitate mai mare (de exemplu, primate non-umane) înainte de a planifica studii clinice în oameni.
În plus, experimente suplimentare ar trebui să investigheze distribuția tisulară a COX7RP, modul în care expresia sa variază cu vârsta în diferite organe și dacă există interacțiuni relevante cu alți factori de longevitate cunoscuți (de exemplu, căile mTOR, AMPK, sirtuinele). Datele longitudinale care combină măsurători metabolice, imagistică mitocondrială și evaluări funcționale vor fi esențiale pentru a înțelege impactul pe termen lung.
Perspective tehnice și detalii de mecanism
Pe plan tehnic, îmbunătățirea structurii mitocondriale prin COX7RP poate fi interpretată ca o reducere a „imperfecțiunilor” respiratorii: o asamblare mai stabilă a complexelor I, III și IV într-un supercomplex permite transferul eficient al electronilor, scurtând timpul de interacțiune cu oxigenul și reducând scăpările către ROS. Aceasta se traduce printr-o sinteză mai eficientă de ATP per moleculă de substrat consumat și printr-un profil redox mai stabil, ceea ce protejează componentele celulare sensibile, cum ar fi ADN-ul mitocondrial, lipidele membranare și proteinele critice.
În plus, consolidarea rețelei mitocondriale poate influența semnalizarea retrogradă către nucleu, afectând expresia genelor implicate în homeostazia energetică, biogeneza mitocondrială și răspunsul la stres. Aceste modificări transcripționale pot contribui la fenotipul observat: îmbunătățirea toleranței la glucoză, reglarea lipidică și creșterea rezistenței musculare. Măsurători ale ATP/ADP, NADH/NAD+ și ale potențialului de membrană mitocondrială au fost probabil parte din evaluarea funcțională care a susținut concluziile autorilor.
Expertiză și evaluare critică
Dr. Elena Marquez, biolog specializat în mitocondrii la o universitate de cercetare, subliniază că studiul oferă o legătură mecanistică clară între arhitectura organitei și îmbătrânirea organismală. Ea explică că țintirea asamblărilor proteice este o strategie nuanțată: modificări relativ mici într-o proteină schelă precum COX7RP pot produce efecte difuze asupra metabolismului celular, dar potențiale efecte off-target și răspunsuri tisulare diferite impun evaluări preclinice riguroase.
Dr. Marquez adaugă că terapii genice sau molecule de precizie care vizează interfețele proteice ar putea apărea în viitor, dar că datele robuste privind siguranța și lipsa efectelor adverse sunt esențiale înainte de a concepe studii clinice în oameni. Ea recomandă, de asemenea, incluziunea unor evaluări funcționale standardizate ale healthspan-ului în modele preclinice, astfel încât beneficiile să nu fie doar statistice, ci și biologic relevante pentru calitatea vieții.
Concluzie
Studiul privind COX7RP evidențiază un mecanism celular fezabil pentru încetinirea unor aspecte ale îmbătrânirii într-un model mamifer. Prin îmbunătățirea organizării și a capacității de producere a energiei a mitocondriilor, cercetătorii au observat câștiguri măsurabile în sănătatea metabolică, rezistență și durată de viață. Traducerea acestor câștiguri la oameni va necesita studii suplimentare, inclusiv protocoale de siguranță, determinări de doze și strategii de livrare; totuși, ideea stabilizării supercomplexelor mitocondriale se conturează ca o țintă promițătoare în căutarea intervențiilor care pot extinde healthspan-ul.
Pe termen mediu și lung, dezvoltarea unor terapii care să moduleze COX7RP sau să reproducă efectele sale ar putea influența managementul bolilor metabolice asociate vârstei și ar putea contribui la strategii integrate pentru promovarea unei vieți mai lungi și mai sănătoase. Combinația dintre date mecanistice solide, validare preclinică extinsă și tehnologii moderne de livrare ar putea transforma această descoperire într-un punct de plecare pentru intervenții translaționale.
Sursa: sciencealert


Lasă un Comentariu