8 Minute
Un medicament pentru tensiune arterială folosit de zeci de ani, hidralazina, a dezvăluit o acțiune moleculară surprinzătoare care ar putea remodela tratamentele atât pentru hipertensiunea în sarcină, cât şi pentru anumite tipuri de cancer cerebral. Cercetătorii afirmă că această descoperire deschide calea către terapii mai sigure și mai țintite și accelerează dezvoltarea farmacologică prin reprofilarea unui compus bine cunoscut. Descoperirea combină avantajele unui profil de siguranță deja stabilit cu perspective moderne de chimie medicinală și terapii țintite, ceea ce poate reduce timpul și costul până la aplicarea clinică. Hidralazina — cunoscută în practica clinică ca antihipertensiv direct-vasodilatator — devine astfel un exemplu de farmacologie retroactivă, unde înțelegerea mecanismelor moleculare permite redirecționarea unei molecule spre indicații noi precum preeclampsia sau vulnerabilități din glioblastom. În contextul medicinei reproductive și al oncologiei neurochirurgicale, o astfel de abordare de „reutilizare” farmaceutică (drug repurposing) este atractivă: există deja date privind farmacocinetica, toxicitatea și dozele sigure la om, ceea ce poate facilita proiectarea studiilor clinice de faze ulterioare.
How an established drug exposed a hidden mechanism
O echipă de oameni de știință care studiau motivul pentru care hidralazina este eficace în tratarea preeclampsiei — o creștere periculoasă a tensiunii arteriale în timpul sarcinii, asociată cu risc materno-fetal semnificativ — a descoperit o cale moleculară anterior necunoscută pe care o afectează medicamentul. Prin cartografierea interacțiunilor biochimice ale hidralazinei la nivel celular și molecular, cercetătorii au reușit să explice beneficiile clinice observate și să contureze pași practici pentru proiectarea unor variante care mențin eficacitatea, dar reduc efectele adverse. Această investigație a folosit combinații de tehnologii — de la proteomică și secvențiere funcțională, la teste de legare directă și modele celulare — pentru a identifica elementele de semnalizare celulară modulate de hidralazină. Rezultatele sugerează că hidralazina nu acționează doar ca vasodilatator hemodinamic, ci influențează și semnale intracelulare legate de homeostaza redox, reglementarea unor enzime cheie și potențial elemente ale reglării epigenetice. În termeni practici, înțelegerea acestor mecanisme oferă un „hărți” pentru chimia medicinală: cunoscând țintele moleculare sau căile afectate, chimiștii pot sintetiza analogi mai selectivi care interacționează preferențial cu componentele dăunătoare în boală, minimizând interacțiunile cu țesuturile sănătoase.
După cum explică chimista Megan Matthews de la Universitatea din Pennsylvania, înțelegerea hidralazinei la nivel molecular oferă o foaie de parcurs pentru crearea unor tratamente mai sigure și mai selective pentru hipertensiunea legată de sarcină. Această perspectivă mecanistică dă, de asemenea, dezvoltatorilor de medicamente un avans competitiv: hidralazina este deja aprobată și utilizată pe scară largă, astfel încât derivatele sau formulările îmbunătățite ar putea ajunge la pacienți mai rapid decât compușii complet noi. În plus, reutilizarea unui medicament aprobat poate facilita aprobările regulatorii prin oferirea unui set de date inițiale privind tolerabilitatea și interacțiunile farmacologice, permițând focalizarea resurselor pe optimizarea selectivității și eficacității pentru noile indicații. În cazul sarcinii, acest lucru este deosebit de important: orice nou tratament trebuie evaluat riguros pentru siguranța atât a mamei, cât și a fătului, iar un profil de siguranță deja stabilit la populații adulte oferă un punct de plecare valoros pentru proiectarea studiilor clinice.
Why this matters for glioblastoma and targeted therapies
Dincolo de obstetrică, noile constatări punctează spre vulnerabilități în glioblastom, o tumoră cerebrală agresivă cu prognostic rezervat și opțiuni terapeutice limitate. Cercetarea sugerează că hidralazina interferează cu căi celulare de care celulele glioblastomului se folosesc pentru supraviețuire, proliferare și adaptare la stresul terapeutic. Dacă oamenii de știință pot regla medicamentul astfel încât să dezactiveze selectiv acele mecanisme de apărare celulară, rezultatul ar putea fi un adjunct eficient la terapiile oncologice existente, incluzând radioterapia, chimioterapia și noile strategii imunoterapeutice. Important din perspectivă terapeutică este conceptul de terapie țintită: nu doar să administrezi un agent citotoxic larg, ci să exploatezi o dependență moleculară specifică a tumorii — de exemplu, o cale metabolică alterată, un factor de transcriere esențial sau o enzimă de reparare a ADN-ului — pentru a crește vulnerabilitatea celulelor tumorale fără a crește toxicitatea sistemică.
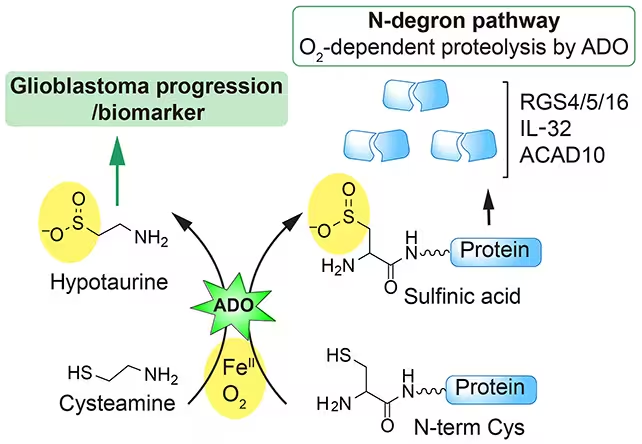
Balancing potency and safety
Reprofilarea medicamentelor are un avantaj clar: profiluri de siguranță cunoscute. Totuși, pentru a trata cancerul cerebral sau complicațiile sarcinii, cercetătorii subliniază necesitatea unui echilibru atent între atingerea anumitor ținte celulare și evitarea afectării țesuturilor sănătoase. În cazul glioblastomului, provocări specifice includ trecerea barierii hemato-encefalice, toxicitatea neuronală potențială și heterogenitatea tumorală care poate conduce la rezistență. Pentru sarcină, preocupările se extind la riscul teratogenității, transferul placentar și efectele pe termen lung asupra dezvoltării fetale. Din acest motiv, optimizarea va necesita eforturi de chimie medicinală pentru a crea analogi ai hidralazinei cu o selectivitate îmbunătățită, strategii de livrare direcționată (de exemplu, vectori nano-carrier, conjugare cu anticorpi sau promedicamente activate în medii tumorale), precum și teste clinice riguroase care să evalueze atât eficacitatea, cât și siguranța pe termen scurt și lung. Alternativ, dezvoltatorii pot explora combinații cu alți agenți care să permită doze mai mici de hidralazină (sau ale sale derivați) menținând eficiența terapeutică și reducând riscul de reacții adverse sistemice.
De asemenea, într-un cadru tehnic, optimizarea ar putea include stabilirea unui index terapeutic clar (raportul dintre doza eficace și doza toxică), studii farmacodinamice care să coreleze biomarkerii moleculari cu răspunsul clinic și modele preclinice relevante (organoide, modele ortotopice de glioblastom, modele de placentă și de sarcină la animale) pentru a valida mecanismele și a estima dozele potrivite pentru etapa clinică. Identificarea biomarkerilor predictivi de răspuns ar fi deosebit de utilă pentru selectarea pacienților care ar beneficia cel mai mult de astfel de terapii țintite, maximizând raportul beneficiu-risc în studiile clinice ulterioare.
What’s next for patients and researchers?
Echipa a publicat lucrarea în Science Advances. Pașii următori includ rafinarea selectivității compusului, teste preclinice axate pe modele de glioblastom și studii clinice concepute pentru a îmbunătăți rezultatele femeilor cu preeclampsie. Imaginați-vă un viitor în care un vechi medicament cardiovascular, reproiectat pe baza unei înțelegeri moleculare moderne, ajută atât mame însărcinate, cât și pacienți cu tumori cerebrale — un scurtcircuit eficient de la bancul de laborator la patul bolnavului. În practică, direcțiile de dezvoltare pot include: 1) sinteza și testarea unei librării de analogi ai hidralazinei pentru a selecta candidați cu legare mai specifică la țintele identificate; 2) studii farmacologice comparate pentru a defini parametrii farmacocinetici ideali (timp de înjumătățire, biodisponibilitate, penetrabilitate în țesutul cerebral); 3) dezvoltarea unor strategii de administrare care reduc expunerea sistemică, cum ar fi formulările inhalabile, administrarea intratecală în context oncologic sau formulările cu eliberare prelungită adaptate obstetricii; și 4) inițierea unor studii clinice de fază I/II bine concepute, cu cohortă de femei însărcinate atent monitorizate și, respectiv, pacienți cu glioblastom recurent sau refractar pentru a evalua semnele inițiale de eficacitate și siguranță.
Este rar ca un medicament clasic pentru hipertensiune să lumineze strategii noi în neuro-oncologie, spune Matthews, iar cercetătorii speră că acesta este începutul unor descoperiri interdisciplinare care se traduc în tratamente reale. Există, totuși, pași importanți între descoperirea mecanistică și standardizarea clinică: validarea rezultatelor în cohorte independente, confirmarea biomarkerilor de răspuns, analiza cost-eficacitate și planificarea logistică pentru implementarea în sistemele de sănătate. În plus, succesul clinic va depinde in parte de cooperarea între echipe multidisciplinare — chimiști medicinali, biologici moleculare, obstetricieni, neuro-oncologi, farmacologi clinici și reglementatori — pentru a asigura că modificările propuse aduc beneficii clare pacienților fără a compromite siguranța. În perspectivă, hidralazina reprofilată ar putea deveni un exemplu prototip pentru modul în care datele mecanistice moderne pot revitaliza arme terapeutice vechi, oferind opțiuni mai bune în condiții dificile precum preeclampsia și glioblastom, unde nevoia de soluții eficiente și rapide este acută.
Sursa: sciencealert

Lasă un Comentariu