8 Minute
O populație foarte mică, sensibilă la stres, de neuroni localizată adânc în cortex ar putea orchestra fluxul sanguin și activitatea electrică în întregul creier. Experimente noi la șoareci sugerează că aceste celule rare — cunoscute drept neuroni nNOS de tip I — au un rol disproporționat în ritmurile cerebrale asociate somnului, în curățarea deșeurilor metabolice și, posibil, în etapele timpurii ale bolilor neurodegenerative.
Cum influențează câteva celule întregul creier
Neuronii nNOS de tip I sunt rari și se găsesc în principal în straturile profunde ale cortexului, dar par să aibă un impact mult mai mare decât ar sugera abundența lor. Cercetători de la Pennsylvania State University au aplicat metode țintite pentru a elimina acest tip celular la șoareci, apoi au monitorizat ce se întâmplă cu fluxul sanguin cerebral global, cu pulsațiile lente ale vaselor numite vasomotricitate, precum și cu activitatea neuronală generală.
Rezultatele au fost remarcabile. Animalele cărora le-au fost eliminate neuronii nNOS de tip I au prezentat un flux sanguin global mai scăzut, vasomotricitate mai slabă și o reducere a ratei de descărcare neuronală. Undele lente delta — ritmurile cerebrale asociate somnului profund și consolidării memoriei — și-au diminuat amplitudinea, iar sincronizarea normală între emisferele stângă și dreaptă s-a deteriorat.
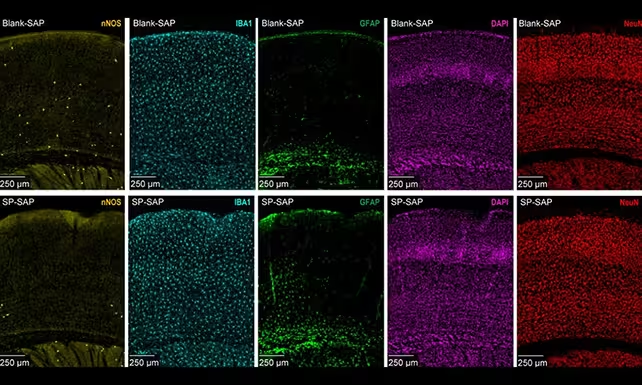
Neuronii nNOS de tip I (marcați în galben) sunt mult mai puțin numeroși decât alte tipuri și au fost eliminați selectiv de către cercetători.
Aceste observații indică faptul că un grup restrâns de neuroni cu proprietăți specifice poate acționa ca un nod de control pentru dinamica vasculară și sincronizarea rețelelor neuronale. Mecanismele prin care acești neuroni influențează tonusul vascular și activitatea electrică pot include semnalizare neurochimică locală, conexiuni cu interneuroni și interferențe cu sistemele care reglează tonusul vaselor cerebrale.
De ce sunt importante vasomotricitatea și undele lente
Vasomotricitatea se referă la dilatarea și constricția ritmică, spontană, a arterelor, venelor și capilarelor cerebrale la intervale de câteva secunde. Această oscilație continuă contribuie la mișcarea fluidului interstițial și a lichidului cefalorahidian prin țesutul cerebral, un proces ce sprijină eliminarea produselor reziduale metabolice. Când vasomotricitatea se slăbește, curățarea proteinelor toxice — precum cele implicate în boala Alzheimer, cum ar fi beta-amiloidul sau tau — poate fi afectată.
Echipa de la Penn State a constatat că scăderea fluxului sanguin și a activității neuronale a fost cel mai pronunțată în timpul somnului, perioadă în care undele delta domină în mod normal. Această corelație deschide o posibilitate esențială: dacă neuronii nNOS de tip I sunt afectați, atât arhitectura somnului, cât și procesele nocturne de „curățare” a creierului ar putea fi compromise. Pe termen lung, astfel de alterări pot contribui la declin cognitiv.
Din perspectivă fiziologică, undele lente (slow waves) și vasomotricitatea sunt interdependente: sincronizarea activității neuronale poate induce variații regionale ale cererii metabolice, iar vasomotricitatea poate facilita redistribuirea fluidelor și nutrienților. Prin urmare, pierderea unei populații neurale care leagă aceste procese ar putea degrada eficiența homeostaziei cerebrale.
Detalii experimentale și implicații
Prin folosirea unor tehnici de ablare celulară selective la șoareci, investigatori au reușit să izoleze rolul neuronilor nNOS de tip I fără a produce leziuni extinse în țesutul înconjurător. Intervenția a redus amplitudinea oscilațiilor vasculare spontane și a atenuat activitatea în undele lente ale creierului. Aceste modificări concomitente în dinamica vasculară și neuronală sugerează că neuronii vizați funcționează ca un hub, sincronizând aprovizionarea sanguină cu activitatea rețelelor neuronale.
Inginerul biomedical Patrick Drew, al cărui laborator a cartografiat anterior reglarea fluxului sanguin asociată cu nNOS, descrie oscilațiile spontane ca fiind modul în care creierul deplasează fluidul prin dilatarea și constricția ritmică a vaselor la intervale scurte. Pierderea neuronilor care ajută la temporizarea și reglarea acestor oscilații, susțin autorii, ar putea declanșa o cascadă de disfuncții ce afectează somnul, clearance-ul deșeurilor și sănătatea cerebrală pe termen lung.
Din punct de vedere experimental, această constatare ridică întrebări despre modalități prin care fragilitatea sau vulnerabilitatea acestor neuroni la stres, inflamație sau îmbătrânire ar putea constitui un mecanism precoce al dispersiunii homeostaziei vasculare. De asemenea, rezultatele sugerează direcții posibile pentru biomarkeri: modificările de vasomotricitate și sincronizare interhemisferică ar putea fi detectabile prin tehnici non-invazive precum ASL-fMRI, EEG combinat cu analiză de coherență sau imagistică optică funcțională.
De la rozătoare la oameni: ce este plauzibil?
Aceste descoperiri provin din modele la șoareci, iar traducerea lor la creierul uman va necesita studii suplimentare. Totuși, multe procese vasculare și neuronale fundamentale sunt conservate la mamifere, astfel că ideea conform căreia o mică populație neuronală vulnerabilă la stres ar putea influența dinamica întregului creier este plauzibilă. Dacă celule similare există în creierul uman și se comportă în mod analog, pierderea lor cauzată de stres cronic, îmbătrânire sau boală ar putea reprezenta un factor subapreciat în inițierea neurodegenerării.
Fluxul sanguin cerebral redus este deja recunoscut ca un element care contribuie la deficitul cognitiv și la demență. Noile date adaugă nuanță, identificând un tip celular specific care leagă tonusul vascular, somnul cu unde lente și sincronizarea interhemisferică — toți factori relevanți pentru menținerea unei cogniții sănătoase.
În plus, conexiunile potențiale cu sistemul glial-glymphatic fac această linie de cercetare relevantă pentru înțelegerea modului în care proteinopatiile se acumulează. Dacă vasomotricitatea compromisă reduce fluxurile perivascularice care alimentează sistemul glymphatic, atunci acumularea graduală a beta-amiloidului sau a tau-ului ar putea fi accelerată, cu impact pe termen lung asupra memoriei și funcțiilor cognitive.
Ce vor studia cercetătorii în continuare
Experimente viitoare vor trebui să confirme dacă creierele umane se bazează pe o populație echivalentă de neuroni nNOS de tip I. O serie de abordări complementare ar putea fi folosite: analize post-mortem pentru a detecta acești neuroni la oameni, secvențierea ARN unicelular pentru a caracteriza profilele moleculare, imagistică funcțională în vivo pentru a corela activitatea acestor regiuni cu vasomotricitatea, și modele de organoide sau studii translante în primate ne-umane pentru a testa conservarea funcției.
Cercetătorii vor investiga, de asemenea, modul în care stresul, inflamația sau îmbătrânirea afectează selectiv aceste celule și dacă pierderea lor precede simptomele cognitive măsurabile. Dacă legătura se confirmă, protejarea sau restabilirea acestui cohort neuronal ar putea deveni o țintă pentru terapii menite să îmbunătățească calitatea somnului și să încetinească procesele neurodegenerative. Intervențiile potențiale includ strategiile anti-inflamatorii, modulatoare ale semnalizării nNOS, terapii vasculare care susțin vasomotricitatea, precum și intervenții comportamentale pentru reducerea stresului și optimizarea higienei somnului.
De asemenea, validarea markerilor imagistici și electrofiziologici ar permite identificarea persoanelor cu risc crescut înainte de debutul clinic, deschizând calea pentru intervenții timpurii. Proiectele viitoare ar putea testa combinații de tratamente vasculoprotective și proceduri care susțin somnul profund pentru a evalua dacă se poate restabili clearance-ul proteic și preveni progresia declinului cognitiv.
Expert Insight
Dr. Claire Mendoza, cercetătoare în neurovasculară care nu a participat la studiu, spune: „Ideea că un tip celular rar poate coordona ritmurile vasculare în întregul creier este captivantă. Aceasta ne schimbă modul de a privi reglarea fluxului sanguin — nu doar ca un răspuns local la activitate, ci ca pe un proces în rețea care susține somnul și curățarea cerebrală. Investigarea rezilienței și vulnerabilității acestor neuroni ar putea deschide strategii preventive noi pentru demență.”
Înțelegerea modului în care stresul afectează acești neuroni are și implicații importante pentru sănătatea publică. Stresul cronic este omniprezent în societatea modernă; dacă el slăbește selectiv celulele care reglează fluxul sanguin cerebral, atunci intervențiile pentru reducerea stresului și măsurile de protecție vasculară pot oferi o cale de a păstra sănătatea creierului odată cu înaintarea în vârstă. Educația privind somnul, managementul stresului, controlul factorilor de risc cardiovascular și cercetările asupra terapiei menite să susțină vasomotricitatea pot deveni componente cheie ale unei strategii integrate de sănătate cerebrală.
În concluzie, descoperirea rolului posibil al neuronilor nNOS de tip I deschide o fereastră nouă asupra modului în care circuitele neuronale și funcțiile vasculare se intersectează pentru a menține homeostazia creierului. Deși este nevoie de confirmare în modele umane, această linie de cercetare oferă perspective promițătoare pentru înțelegerea mecanismelor timpurii care pot conduce la declin cognitiv și pentru dezvoltarea de intervenții terapeutice și preventive.
Sursa: sciencealert

Lasă un Comentariu