10 Minute
Imaginează-ți un punct de vedere contrar intuiției în biologia cancerului: animale foarte în vârstă care dezvoltă mai puțin cancer, nu mai mult. Cercetări noi de la Universitatea Stanford arată că șoarecii la vârste înaintate dezvoltă tumori pulmonare mai puține și de dimensiuni mai mici decât animalele tinere care au aceleași mutații oncogene. Rezultatele contestă presupunerea simplistă că riscul de cancer crește necontrolat odată cu trecerea timpului și sugerează schimbări asociate vârstei care, paradoxal, pot suprima formarea tumorilor.
Cercetătorii din spatele studiului afirmă că descoperirile ajută la explicarea unui tipar uman observat de mult timp: incidența cancerului crește până în maturitate târzie, dar adesea se stabilizează sau chiar scade la vârstnici extreme. Echipa de la Stanford a folosit șoareci modificați genetic și analize moleculare minuțioase pentru a investiga care aspecte ale îmbătrânirii ar putea limita cancerul și cum se comportă mutații specifice diferit de-a lungul duratei de viață.
A surprising pattern in old mice: fewer, smaller lung tumors
Grupul de la Stanford a comparat formarea tumorilor în două cohorte de vârstă ale șoarecilor de laborator: adulți „tineri” (patru până la șase luni) și animale care au ajuns la vârstă înaintată (20 până la 21 de luni, echivalent aproximativ al unei vârste umane extreme). Pentru a declanșa cancerul pulmonar, cercetătorii au folosit un sistem țintit de livrare a genelor prin inhalare care produce tumori etichetate fluorescent, permițând imagistică și măsurători precise.
După inducerea cancerului și o perioadă de așteptare de 15 săptămâni, contrastul a fost marcant. Șoarecii tineri au dezvoltat aproximativ de trei ori mai mare sarcină tumorală, măsurată prin greutatea plămânilor și aria fluorescentă, și au avut cam de trei ori mai multe tumori individuale. Tumorile la animalele tinere au fost, de asemenea, mai mari și cu creștere mai rapidă. Pe scurt, prin toate metricele utilizate, șoarecii tineri au prezentat o boală mai agresivă.
Aceste rezultate oglindesc observații epidemiologice la oameni: ratele de cancer urcă în timpul vieții adulte și în vârstă, dar adesea se plafonează sau scad după aproximativ 85 de ani. Până acum, oamenii de știință au dezbătut dacă acea scădere se datorează testărilor medicale mai puțin frecvente și subdiagnosticării la foarte bătrâni sau unor factori biologici care reduc apariția tumorilor. Noile date pe modele murine sugerează un efect biologic real, legat de vârstă, care suprimă inițierea și creșterea tumorilor.
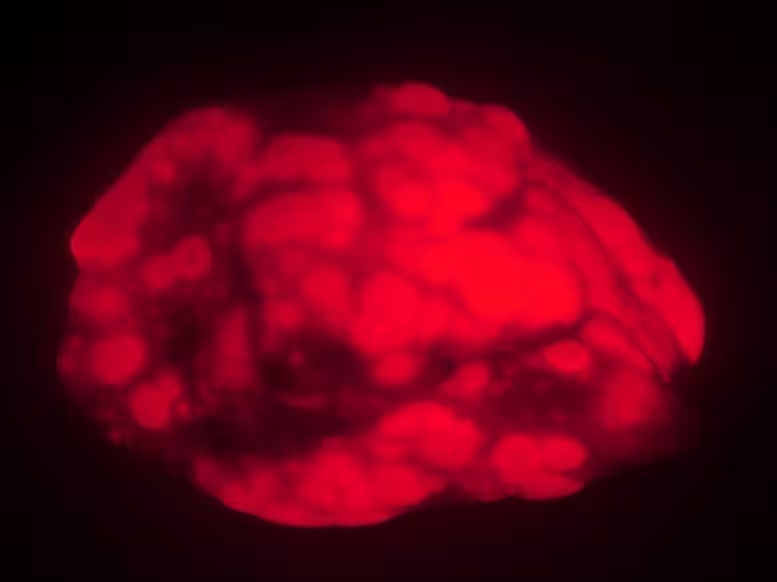
Șoarecii în vârstă dezvoltă tumori pulmonare mai puține și mai mici (roșu) decât animalele tinere într-un model de cancer. Descoperirile sugerează că, la animale sau oameni foarte în vârstă, procesul de îmbătrânire poate suprima formarea cancerului.
What changes with age could block cancer?
La prima vedere, îmbătrânirea pare să favorizeze cancerul: fiecare diviziune celulară presupune riscul de deteriorare a ADN-ului, iar multe semne ale îmbătrânirii — instabilitate genomică, modele modificate de metilare a ADN-ului și reorganizări ale ADN-ului mitocondrial — par teren fertil pentru transformarea malignă. Pe parcursul marei părți a vieții adulte, această acumulare de daune corelează cu creșterea incidenței cancerului.
Totuși, echipa de la Stanford susține că unele modificări asociate vârstei pot deveni ostile neoplaziei. Studiul a examinat cum inactivarea unui panou de 25 de gene cunoscute ca supresoare tumorale a afectat formarea tumorilor la șoareci tineri comparativ cu cei bătrâni. Genele supresoare tumorale codifică proteine care în mod normal controlează creșterea celulară necontrolată; atunci când aceste gene se pierd sau sunt dezactivate, cancerele apar mai ușor.
Deși dezactivarea multor gene supresoare a crescut numărul tumorilor în ambele grupe de vârstă, magnitudinea efectului a fost aproape invariabil mai mare la șoarecii tineri. Cu alte cuvinte, aceeași lovitură genetică producea un rezultat mai sever în tinerețe. O genă a ieșit în evidență: PTEN. Inactivarea PTEN a avut un efect de promovare tumorală mult mai puternic la animalele tinere decât la cele în vârstă, ceea ce implică faptul că contextul biologic al unui țesut îmbătrânit modifică modul în care funcționează o cale majoră de cancer.
Pentru a investiga mecanismele, cercetătorii au secvențiat modelele de expresie genică în celulele canceroase provenite de la șoareci bătrâni versus tineri și din tumori cu sau fără PTEN. În mod neașteptat, chiar și celulele canceroase care se divizau rapid, izolate din animalele în vârstă, au păstrat semnături moleculare asociate îmbătrânirii. Aceste pattern-uri transcripționale legate de vârstă s-au diminuat atunci când PTEN a fost inactivat, iar celulele canceroase deficiente în PTEN din șoarecii în vârstă au semănat cu profilul de expresie genică al tumorilor tinere — un indiciu interesant că unele trăsături ale îmbătrânirii pot fi șterse când căi-cheie sunt perturbate.
A brief note on technical context
Studiul a utilizat etichetare fluorescentă pentru a cuantifica sarcina tumorală, unelte controlate de inactivare genetică pentru a testa efectele genelor supresoare și profilare ARN pentru a examina cum semnăturile de îmbătrânire persistă în celulele transformate. Designul experimental a necesitat o durată lungă — cercetătorii au așteptat aproape doi ani pentru ca șoarecii să ajungă la vârsta avansată, subliniind de ce efectele îmbătrânirii sunt greu de studiat experimental. În plus, procedurile de imagistică de înaltă rezoluție și analizele bioinformatică pe transcriptom au permis detectarea diferențelor subtile în semnăturile epigenetice și în expresia genică care pot modula susceptibilitatea la cancer.
Why the findings matter for cancer research and treatment
Consecințele practice sunt substanțiale. În primul rând, modelele de cancer utilizate frecvent — adesea bazate pe șoareci adulți tineri — pot să nu capteze biologia dependentă de vârstă. Aceasta poate denatura testările preclinice ale terapiilor vizate, care ar putea avea un comportament diferit în țesuturi mai în vârstă, unde peisajul molecular s-a schimbat. Astfel, validitatea externă a multor studii preclinice ar putea fi limitată atunci când se încearcă tranziția către pacienți în vârstă.
În al doilea rând, studiul sugerează că îmbătrânirea nu este universal favorabilă tumorilor. Unele aspecte ale microambientului îmbătrânit sau modificările intrinseci celulare pot opune rezistență inițierii tumorale sau pot încetini progresia. Înțelegerea acelor mecanisme protective ar putea dezvălui strategii terapeutice noi: dacă îmbătrânirea reconfigurează țesutul astfel încât devine mai rezistent la cancer, putem reproduce acea reconfigurare terapeutic?
În al treilea rând, efectul diferențial al inactivării PTEN avertizează că mutații driver specifice și tratamentele țintite la adresa lor pot funcționa diferit în funcție de vârstă. Oncologia de precizie potrivește de obicei medicamente cu profilul mutațional — dar contextul legat de vârstă poate modula potența acelor mutații și, în consecință, eficacitatea terapiilor care le vizează. Aceasta are implicații pentru proiectarea studiilor clinice și pentru personalizarea tratamentelor oncologice în funcție de vârsta biologică a pacientului.
Monte Winslow, profesor asociat de genetică și patologice și autor senior al lucrării, spune că rezultatele cer o reevaluare a alegerii modelelor pentru cercetarea translatională. Dmitri Petrov, coautor senior, încadrează descoperirea într-o perspectivă mai largă: îmbătrânirea poate aduce beneficii subestimate pe care oamenii de știință le-ar putea învăța să valorifice. Aceste observații subliniază necesitatea includerii variabilei vârstă în proiectarea experimentală, atât pentru studii de bază, cât și pentru cele aplicate.
Expert Insight
Dr. Lena Morales, un cercetător fictiv în geroscience (University Center for Aging Biology), comentează: "Aceste date subliniază că îmbătrânirea nu este un declin liniar unic. Unele căi celulare care se schimbă odată cu vârsta pot crea microenvironmente mai puțin permisive pentru inițierea tumorilor. Asta nu înseamnă că îmbătrânirea protejează în general — adulții vârstnici se confruntă cu mai multă fragilitate și alte afecțiuni — dar deschide o direcție valoroasă de cercetare: ce caracteristici protective ale țesuturilor îmbătrânite putem izola și traduce în terapii?"
Opinia ei evidențiază o provocare majoră de cercetare: a separa schimbările asociate vârstei care sunt benefice de cele dăunătoare și, apoi, a determina care dintre ele pot fi replicate în siguranță farmacologic. Acest demers implică o combinație de studii mecanistice, analize epigenetice și modele preclinice diversificate din punct de vedere al vârstei, pentru a evalua riscurile și beneficiile fiecărei intervenții propuse.
Broader implications and next steps
- Model development: Laboratoarele ar trebui să includă animale îmbătrânite în fluxurile preclinice pentru a surprinde efectele dependente de vârstă asupra biologiei tumorale și a răspunsului la terapie. Aceasta poate implica investirea în facilități pentru reproducerea și întreținerea coloaniilor de animale pe termen lung și adaptarea protocoalelor de dozare la schimbările fiziologice asociate vârstei.
- Mechanistic work: Cercetătorii trebuie să identifice ce semnături de îmbătrânire — marcaje epigenetice, schimbări metabolice, remodelări ale sistemului imunitar sau modificări ale matricii extracelulare — conduc la suprimarea tumorilor în țesuturile bătrâne. Lucrări complementare ar trebui să combine analize de single-cell RNA-seq, ATAC-seq pentru accesibilitate cromatină și profilare proteomică pentru a cartografia schimbările critice.
- Clinical translation: Dacă mecanismele protective legate de îmbătrânire sunt validate, ele ar putea inspira medicamente care imită acele stări la pacienții mai tineri sau ar putea îmbunătăți terapiile la pacienții vârstnici în moduri care respectă diferențele fiziologice. Trebuie elaborate criterii de securitate riguroase, deoarece replicarea unor aspecte ale îmbătrânirii ar putea avea efecte adverse dacă nu sunt bine înțelese.
Studiul, condus de autoarea principală Emily Shuldiner și publicat pe 4 noiembrie în Nature Aging, reprezintă una dintre primele demonstrații controlate că îmbătrânirea poate suprima activ inițierea și creșterea tumorilor într-un model mamifer. De asemenea, arată că semnăturile moleculare legate de vârstă pot persista în interiorul celulelor canceroase care se divid, complicând presupunerile despre cum ar trebui să arate "celulele canceroase tinere" la nivelul transcriptomului.
Per ansamblu, lucrarea reframează modul în care se privește îmbătrânirea în cercetarea cancerului: în loc să se vadă vârsta numai ca o acumulare de daune, oamenii de știință ar trebui să o considere o schimbare complexă, sistemică, care uneori stabilește noi constrângeri asupra celulelor maligne. Urmarea acestui fir ar putea dezvălui strategii noi pentru prevenție și terapie, adaptate la biologia grupelor de vârstă diferite. În viitor, un mix de instrumente moleculare, analize de sistem și studii clinice stratificate pe vârstă va fi esențial pentru a traduce aceste descoperiri într-un beneficiu terapeutic real, reducând incidența și mortalitatea prin cancer pulmonar și alte tipuri de cancer în mod responsabil și eficient.
Sursa: scitechdaily

Lasă un Comentariu