7 Minute
Cercetătorii experimentează cu bacterii modificate genetic care caută și atacă tumorile — o idee îndrăzneață care ar putea transforma tratamentul cancerului din pastile fixe în terapii vii adaptative. Trialurile umane timpurii arată rezultate promițătoare, dar siguranța, dozarea și containerea rămân obstacole critice înainte ca aceste „medicamente vii” să intre în practica clinică de rutină. Dezvoltarea terapiilor cu bacterii implică inginerie genetică, biotehnologie, reglementări stricte și colaborare între oncologi, microbiologi și specialiști în sănătate publică.
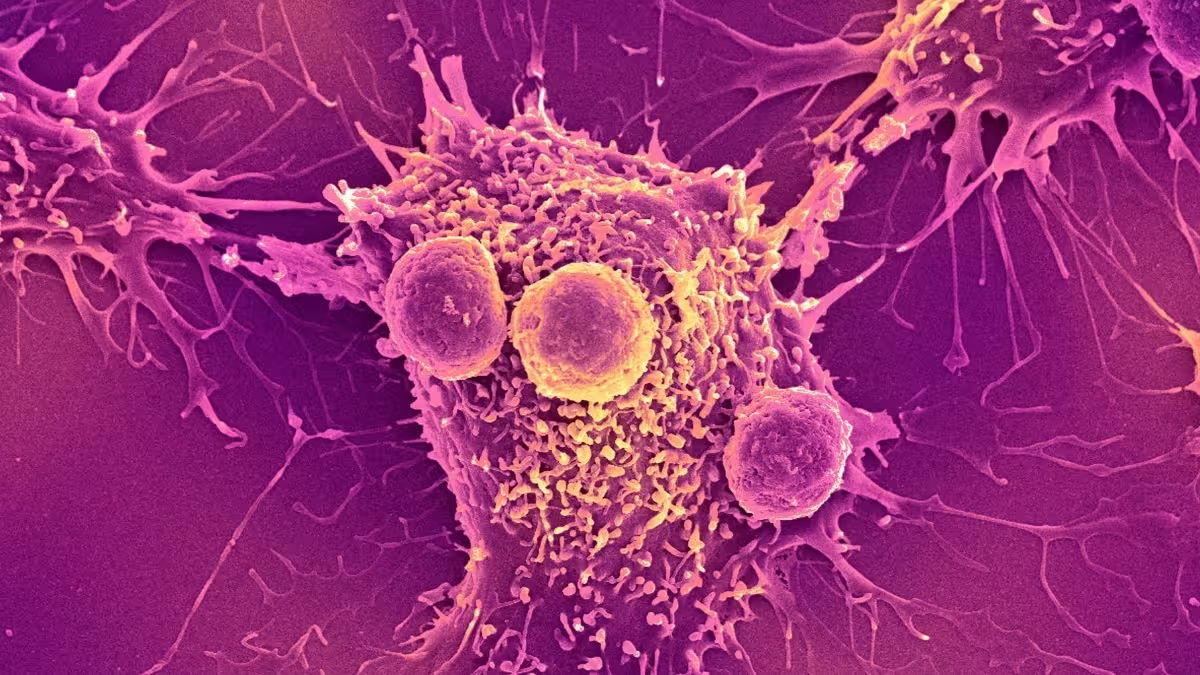
De ce bacterii? Un nou tip de luptător împotriva cancerului
Anumite bacterii se orientează natural către regiuni cu oxigen scăzut (hipoxie) și resurse nutritive limitate din interiorul tumorilor solide. Inginerii biologici valorifică acest comportament: microbii pot fi reprogramați pentru a livra încărcături anti-cancer (proteine citotoxice, citokine, enzime care activează promedicamente), pentru a stimula sistemul imunitar sau pentru a raporta starea tumorală prin biomarkeri detectabili. Imaginați-vă un curier microscopic care se multiplică la locul bolii și își adaptează răspunsul — acesta este atractivul terapiilor cu bacterii.
În practica de laborator și în studii preclinice au fost folosite tulpini precum attenuate Salmonella, Clostridium (de exemplu Clostridium novyi-NT), Listeria monocytogenes și E. coli (incluzând variante probiotice cum e E. coli Nissle) — fiecare oferind avantaje diferite în privința tropismului tumoral, capacitatii de a penetra țesuturi necrotice și potențialului de a fi inginerizate. Mecanismele includ: colonizarea zonelor hipoxice care sunt mai puțin accesibile medicamentelor convenționale, exprimarea de proteine care pot atrage celulele imune antitumorale (de exemplu recrutorii de macrofage sau celule T), și activarea locală a unor promedicamente (enzime bacteriene transformă compuși inactivi în agenți citotoxici la nivelul tumorii). Aceste strategii permit o acțiune țintită, reducând expunerea sistemică și potențialele efecte secundare asociate chimioterapiei tradiționale și radioterapiei.
Pe lângă livrarea directă a agenților terapeutici, bacteriile pot funcționa ca senzori biologici: secvențe raportor exprimate de microbii din tumori pot fi detectate prin imagistică moleculară sau prin analize de sânge, oferind informații despre încărcătura tumorală, răspunsul la tratament și evoluția bolii. Această combinație de diagnostic și terapie (teranostic) este un domeniu activ de cercetare în oncologie experimentală.
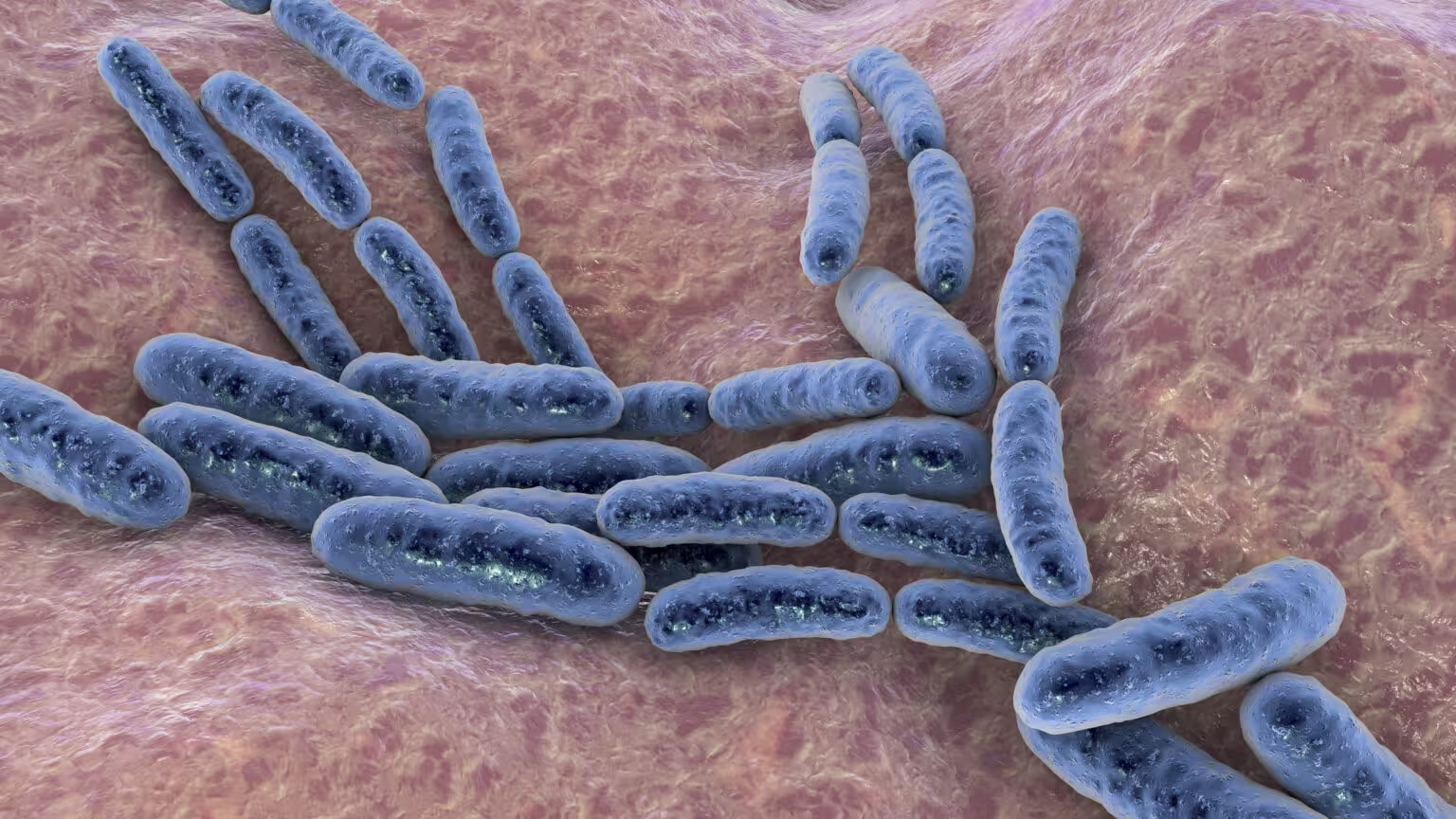
Siguranța pe primul loc: dozare, risc de infecție și reacții imune
Trialurile de fază incipientă indică faptul că aceste abordări pot fi tolerate, dar determinarea dozei corecte reprezintă un echilibru delicat. O doză prea mică poate fi ineficientă; una prea mare poate declanșa infecții necontrolate, inflamații grave sau sindrom de eliberare a citokinelor (cytokine release syndrome). Chiar și tulpinile atenuate, proiectate pentru a reduce virulența, pot evolua în mediul gazdei — de aceea supravegherea continuă, prin monitorizare clinică și secvențiere genomică, este esențială.
Riscurile asociate includ: sepsis, reacții imunologice sistemice (de exemplu febră, șoc inflamator), eliberare de endotoxine (în special cu bacterii Gram-negative), transfer orizontal de gene care ar putea conferi rezistență la antibiotice și stabilitate genetică redusă a circuitelor introduse. Strategii clinice pentru a gestiona aceste riscuri includ planuri de intervenție cu antibiotice țintite, utilizarea de tulpini sensibile la antibioticele de rezervă, și dezvoltarea circuitelor genetice care permit oprirea rapidă a populației bacteriene (kill-switch) în caz de eveniment advers.
Dozarea și rutele de administrare variază: administrarea intratumorală poate limita expunerea sistemică și permite concentrații locale mai mari, în timp ce administrarea intravenoasă poate ajuta la tratarea bolii metastatică dar crește riscul reacțiilor sistemice. De asemenea, regimul de dozare poate include doze unice urmate de supraveghere intensă sau administrări repetate la doze mici pentru a controla proliferarea microbiană. Biomarkerii inflamatori (de exemplu IL-6, CRP), semne clinice și tehnici imagistice (PET, CT, imagistică moleculară bazată pe raportori bacterieni) sunt folosite pentru evaluarea răspunsului și a siguranței.
Biocontainment: siguranțe proiectate pentru a limita riscul
Pentru a diminua pericolele, cercetătorii dezvoltă strategii de biocontainment — comutatoare genetice, „kill-switches” și desainuri care limitează creșterea bacteriană, restricționează activitatea la mediul tumoral sau declanșează autodistrugerea după îndeplinirea unei sarcini. Exemple tehnice includ:
- auxotrofii: tulpini dependente de un nutrient sintetic absent în mediul extern (de ex. un aminoacid sintetic) astfel încât bacteria nu poate supraviețui în afara condițiilor controlate;
- circuite de auto-distrugere induse de semnale ambientale sau de un medicament administrat pacientului (inducere farmacologică a kill-switch-ului);
- quorum sensing inversat pentru a limita populațiile microbiene peste un prag critic;
- sisteme CRISPR care vizează genomul bacteriei în condiții predeterminate pentru a bloca replicarea dacă apar mutații nedorite;
- containment fizic și proceduri de manipulare în producție și eliminare a deșeurilor conform standardelor BSL/GMP.
Aceste barriere biologice încearcă să prevină diseminarea către țesuturi sănătoase, să reducă șansa apariției unor mutații adaptative și să limiteze riscul de transfer genetic către microbiota umană. Totuși, nu există soluții absolute: fiecare nivel de siguranță adăugat poate introduce complexitate tehnică, costuri suplimentare și provocări de scalare pentru producția la scară clinică.
Calea reglementară și perspectivele viitoare
Dincolo de succesul în laborator, „medicamentele vii” trebuie să treacă prin trialuri clinice riguroase și revizuire reglementară. Agenții precum FDA (Statele Unite) sau EMA (Uniunea Europeană) cer date solide de siguranță, eficacitate, stabilitate genetică și biocontainment. Cerințele includ studii preclinice pe modele relevante, studii toxice, demonstrarea controlului asupra producției și asupra calității loturilor (GMP), precum și planuri robuste de farmacovigilență post-marketing.
Dacă vor obține aprobarea, am putea asista la o schimbare fundamentală: trecerea de la medicamente statice, cu o moleculă activă constantă, la sisteme biologice adaptive care pot răspunde dinamic la evoluția bolii. Această tranziție promite o îngrijire oncologică mai precisă, potențial mai eficientă și cu toxicitate redusă local, dar numai dacă regimul de siguranță și supraveghere evoluează la fel de rapid ca tehnologia.
Perspectivele includ integrarea bacteriilor terapeutice cu imunoterapii existente (de exemplu inhibitori PD-1/PD-L1 și CTLA-4), combinarea cu radioterapie sau cu terapii care modifică microambianta tumorală, și utilizarea bacteriilor ca platforme pentru livrarea de vaccinuri antitumorale personalizate. În plus, progresele în ingineria circuitelor genetice, biosenzorii interni și instrumentele de secvențiere rapidă vor îmbunătăți controlul și predictibilitatea acestor tratamente.
Totuși, provocările rămân: scalarea producției sub standarde GMP, asigurarea stabilității genetice pe termen lung, prevenirea transferului de gene care ar putea favoriza rezistența la antibiotice, gestionarea percepției publice și asigurarea unei reglementări armonizate la nivel internațional. Colaborarea interdisciplinară, dialogul cu societatea civilă și transparența în comunicarea riscurilor și beneficiilor vor fi cruciale pentru acceptarea și succesul clinic al terapiilor vii.
Pe termen lung, terapiile cu bacterii pot redefine tratamentul cancerului ca un efort adaptativ: sisteme biologice care învață și se ajustează în timp, integrate în strategii de medicină personalizată. Aceasta nu este doar o schimbare tehnologică, ci și una paradigmatică, cu implicații pentru cercetare, clinică, reglementare și etică în oncologie.
Sursa: sciencealert

Lasă un Comentariu