8 Minute
Cercetătorii au identificat o cale surprinzătoare pentru a crea celule producătoare de insulină: reprogramarea ţesutului gastric uman. Folosind organoide gastrice cultivate în laborator şi un „comutator” genetic programabil, oamenii de ştiinţă au convertit celulele gastrice în celule asemănătoare beta care pot secreta insulină şi contribuie la reglarea glicemiei la şoareci diabetici. Această abordare combină tehnici moderne de biologie celulară, inginerie genetică şi modele organoide pentru a explora o alternativă la metodele convenţionale de înlocuire a celulelor beta.
De la organoide gastrice la fabrici de insulină
Diabetul zaharat tip 1 apare atunci când pancreasul pierde sau distruge celulele beta specializate care produc insulină, lăsând pacienţii dependenţi de injecţii de insulină pe termen lung şi de monitorizarea continuă a glicemiei. Pentru a înlocui celulele beta pierdute, comunitatea ştiinţifică a investigat multiple direcţii — de la izole derivate din celule stem până la transplanturi de la donatori — dar fiecare strategie se loveşte de obstacole majore, precum respingerea imună, disponibilitatea limitată a ţesutului donator şi complexitatea fabricaţiei la scară clinico-industrială.
Acum, o echipă internaţională condusă de Xiaofeng Huang (Weill Cornell Medicine, SUA) şi Qing Xia (Peking University, China) a adaptat o alternativă ingenioasă: valorificarea celulelor deja prezente în organism. Pornind de la experimente anterioare pe şoareci, cercetătorii au cultivat modele miniaturale de stomac uman, numite organoide gastrice, care reproduc caracteristici funcţionale şi structurale esenţiale ale ţesutului gastric. Apoi au introdus un set programabil de factori genetici — practic un comutator molecular activabil — capabil să determine acele celule gastrice să adopte o identitate asemănătoare celulelor beta pancreatice atunci când este activat. Această strategie explorează conceptul de reprogramare celulară în locul transplantului clasic, orientându-se spre terapii autologe sau in situ.
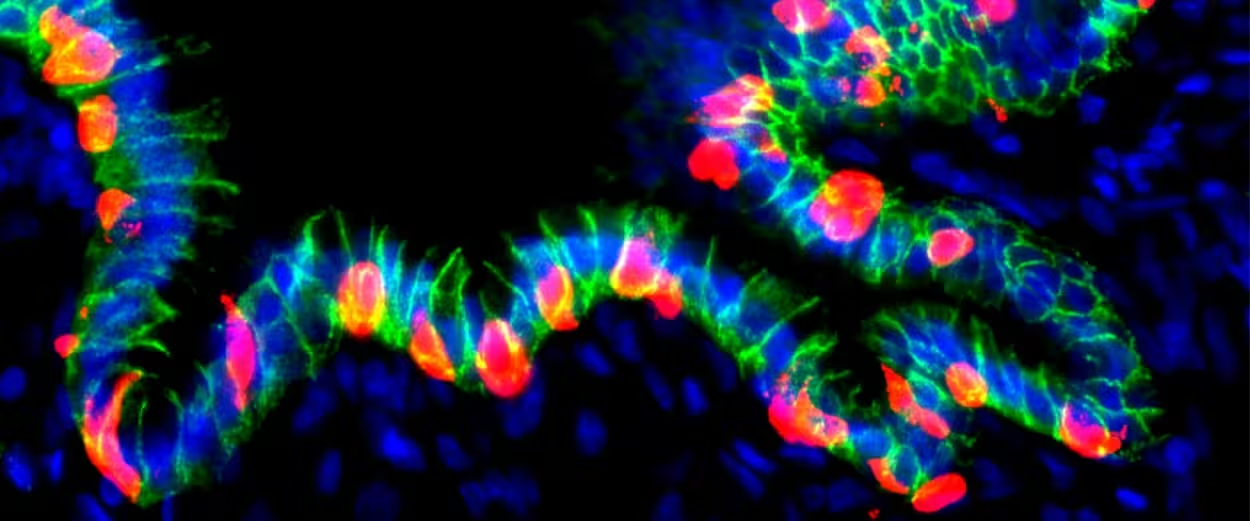
Grefe hGO-NPM generează celule pozitive pentru insulină
Cum a funcţionat reprogramarea
- Echipa a cultivat organoide gastrice umane in vitro pentru a obţine o sursă regenerabilă de celule. Aceste organoide reproduc arhitectura şi semnalele microambientului gastric, oferind un material biologic standardizat pentru experimentare şi potenţiale aplicaţii terapeutice.
- Au inginerizat organoidele cu un program genetic controlabil, conceput să activeze gene şi proteine specifice celulelor beta atunci când este stimulat. Acest comutator molecular programabil permite inducerea expresiei factorilor de transcripţie şi a enzimelor implicate în sinteza şi ambalarea insulinei, fără a transforma complet identitatea originară a celulelor.
- După transplantul acestor organoide modificate în cavitatea abdominală a şoarecilor, ţesuturile s-au integrat cu vasele de sânge locale şi au supravieţuit timp de luni de zile, demonstrând potenţialul pentru vascularizare şi întreţinere pe termen mediu. Integrarea vasculară este esenţială pentru furnizarea de oxigen, nutrienţi şi pentru eliberarea rapidă a insulinei în circulaţie.
- Când comutatorul a fost activat, celulele gastrice derivate din organoide au început să producă insulină şi au prezentat markeri genetici şi de proteine similari cu cei ai celulelor beta pancreatice. Aceste celule „beta-like” au răspuns la stimulii glicemici într-o măsură funcţională, oferind dovezi morfofuncţionale că reprogramarea poate genera celule capabile să contribuie la reglarea glicemiei.
De ce este important pentru diabetul zaharat tip 1
La şoarecii diabetici, insulina eliberată de celulele stomacului convertite a contribuit la reglarea glicemiei şi a îmbunătăţit parametrii clinici ai bolii — un element cheie de tip proof-of-concept. Acest rezultat sugerează că reprogramarea organelor uşor accesibile ar putea completa sau, în anumite situaţii, înlocui terapiile bazate pe transplantul de celule beta sau izole. Din punct de vedere translational, ţesutul gastric are un avantaj practic: poate fi accesat cu proceduri minim invazive, precum endoscopia, ceea ce deschide calea pentru reprogramarea in situ a celulelor pacientului, reducând astfel riscurile asociate cu lipsa donatorilor şi diminuând probabilitatea respingerii imune pentru terapii autologe.
De asemenea, abordarea pune în prim-plan mai multe concepte relevante pentru terapia regenerativă pentru diabet: posibilitatea de a obţine o sursă locală şi personalizată de celule producătoare de insulină, reducerea dependenţei de transplante clasice şi integrarea cu tehnologii de protecţie imună, precum încapsularea celulară sau imunosupresia locală dirijată. Termenii-cheie aici includ reprogramare celulară, celule beta, organoide gastrice şi terapii bazate pe celule autologe.
Desigur, există provocări semnificative înainte de orice aplicaţie clinică la oameni. Studiul este raportat în Stem Cell Reports (6 noiembrie), iar autorii subliniază necesitatea unor demonstraţii detaliate privind siguranţa, durabilitatea şi funcţionalitatea pe termen lung înainte de a demara teste clinice umane. Întrebări esenţiale includ controlul precis al reprogramării pentru a evita supraexpresia sau activarea inadecvată a genei, prevenirea comportamentelor celulare neintenţionate (cum ar fi proliferarea necontrolată sau diferenţierea spre linii celulare nedorite) şi garantarea că sistemul imunitar nu va ataca noile celule producătoare de insulină, în special în contextul autoimunităţii care stă la baza diabetului tip 1.
Următorii paşi: direcţii şi provocări
Munca viitoare va viza rafinarea comutatorului genetic, testarea supravieţuirii şi funcţiei pe perioade mai lungi şi dezvoltarea de strategii pentru a proteja celulele convertite de atacul autoimun caracteristic diabetului de tip 1. Printre direcţiile concrete se numără optimizarea panoului de factori genetici (de exemplu, factori de transcripţie şi module reglementare), integrarea sistemelor de control inducibil — care să permită pornirea şi oprirea expresiei în funcţie de necesitate — şi verificarea răspunsului acestor celule la fluctuaţiile fiziologice ale glucozei.
Pe lângă optimizarea genetică, soluţii complementare includ tehnologii de încapsulare care izolează celulele modificate de sistemul imunitar fără a împiedica schimbul de nutrienţi şi hormoni, strategii de tolerizare imună care pot bloca reacţia autoimună specifică şi dezvoltarea unor platforme de fabricaţie scalabile pentru organoide modificate la standarde GMP (Good Manufacturing Practice). Fiecare etapă presupune provocări tehnice, reglementare şi etice: trebuie determinate criteriile de calitate pentru organoide, schemele de dozare şi amplasare a grefelor, precum şi monitorizarea pe termen lung a pacienţilor pentru a detecta efecte adverse tardive.
De asemenea, este importantă compararea reprogramării gastrice cu alte strategii de terapie regenerativă pentru diabet, cum ar fi izolele derivate din celule stem pluripotente induse (iPSC), encapsularea izoletelor de la donatori şi terapiile medicamentoase imunosupresoare. Avantajele reprogramării in situ includ potenţialul de proceduri minim invazive şi de a folosi ţesut autolog, dar dezavantajele potenţiale includ complexitatea controlului genetic şi riscul unor fenomene neprevăzute în microambientul gastric.
Din punct de vedere clinic şi de reglementare, tranziţia la studii la om va necesita protocoale clare de siguranţă, date preclinice robuste privind biodistribuţia şi potenţiale efecte off-target şi dezvoltarea unor biomarkeri pentru a monitoriza în timp real funcţia celulelor reprogramate. De asemenea, este probabil necesară o colaborare strânsă între cercetători, companii biotehnologice şi autorităţi de reglementare pentru a defini criteriile de succes şi parametrii de securitate pentru încercări clinice iniţiale.
Pe plan mai larg, dacă reuşita se confirmă şi se dovedeşte sigură şi eficientă la om, reprogramarea gastrică ar putea completa instrumentarul terapeutic pentru diabetul zaharat tip 1: alături de izole derivatelor din celule stem, tehnologii de încapsulare şi terapii imunosupresoare sau imunomodulatoare, oferind opţiuni multiple pentru restabilirea producţiei fiziologice de insulină. Această pluralitate de strategii este esenţială, deoarece este puţin probabil ca o singură soluţie să fie optimă pentru toţi pacienţii, având în vedere variabilitatea clinică şi imunologică a diabetului.
Pentru moment, studiul oferă un proof-of-concept intrigant: stomacul, organ în mod normal asociat digestiei şi nu controlului glicemic, poate fi redepus într-un rol terapeutic — potenţial ca sursă de celule producătoare de insulină. Această schimbare de perspectivă deschide posibilităţi noi pentru terapiile celulare în diabet şi evidenţiază abordările creative pe care oamenii de ştiinţă le folosesc pentru a combate boli cronice. Totodată, reuşita subliniază importanţa cercetării interdisciplinare, a modelelor organoide şi a ingineriei genetice în dezvoltarea terapiilor regenerative pentru diabet zaharat tip 1.
Sursa: scitechdaily

Lasă un Comentariu