9 Minute
O echipă de oameni de știință de la University of Wisconsin–Madison a descoperit un parteneriat molecular neașteptat care contribuie la protejarea capetelor cromozomiale. Această descoperire conectează o proteină bine cunoscută pentru legarea ADN-ului cu activitatea telomerazei, oferind o explicație pentru motivele pentru care unii pacienți dezvoltă tulburări grave, amenințătoare de viață, caracterizate prin telomeri anormal de scurți.
De ce sunt importanți telomerii și de unde a pornit misterul
Telomerii sunt structuri repetitive de ADN și proteine aflate la capetele cromozomilor, care împiedică degradarea și „destrămarea” genomului la fiecare diviziune celulară. În mod normal, la fiecare diviziune celulară telomerii se scurtează ușor — un mecanism biologic asociat procesului de îmbătrânire celulară. Când telomerii se scurtează excesiv sau nu sunt întreținuți corespunzător, instabilitatea genetică crește, ceea ce poate determina oprirea diviziunii celulare sau moartea celulară programată. Aceste procese stau la baza unor sindroame de îmbătrânire prematură și a unor boli hematologice severe.
Legătura dintre defectele în telomerază — enzima responsabilă pentru reconstituirea telomerilor — și boli clinice precum anemia aplastică, sindromul mielodisplazic sau leucemia mieloidă acută este bine documentată. Totuși, în numeroase cazuri clinice în care pacienții prezintă telomeri extrem de scurtați, nu a fost identificată nicio mutație directă în genele componente ale telomerazei care să explice fenotipul. Această lacună în înțelegere a fost unul dintre principalele motoare ale studiului recent, care a căutat factori adiționali ce reglează activitatea telomerazei și menținerea telomerilor.
Cum a intrat în prim-plan un partener neașteptat
Coordonat de profesorul Ci Ji Lim, grupul de la UW–Madison a folosit AlphaFold, un instrument de învățare automată pentru predicția structurilor și interacțiunilor proteice, pentru a scana proteine umane care ar putea interacționa cu telomeraza umană. Screeningurile computaționale au identificat replication protein A (RPA) — o proteină omniprezentă ce leagă ADN-ul monocatenar și care este cunoscută, în principal, pentru rolurile sale în replicarea și repararea ADN-ului — drept un partener plauzibil pentru telomerază.
Identificarea RPA ca posibil cofactor al telomerazei a fost semnificativă din perspectiva mecanistică deoarece RPA este implicată în protejarea ADN-ului monocatenar expus în timpul replicării și în gestionarea stresului replicativ. Faptul că această proteină ar putea avea și o funcție de reglare directă asupra telomerazei deschide perspective noi asupra modului în care celulele coordonează replicarea terminală a cromozomilor și răspunsul la leziuni genomice.
From model to molecule: experimental validation
Urbanizat de predicțiile AlphaFold, studentul absolvent Sourav Agrawal, cercetătorul științific Xiuhua Lin și postdoctorandul Vivek Susvirkar au realizat o serie de experimente biochimice menite să valideze ipoteza computațională. În experimente de laborator asupra celulelor umane, RPA s-a dovedit necesară pentru stimularea activității telomerazei și pentru menținerea lungimii telomerilor. Cu alte cuvinte, pe lângă faptul că RPA se leagă de ADN monocatenar în timpul replicării și al reparației, ea contribuie activ la funcționarea telomerazei la capetele cromozomilor.
Validările au inclus abordări biochimice clasice: imunoprecipitări (co‑IP) pentru a demonstra complexarea fizică între componente, teste funcționale de activitate a telomerazei (de tip TRAP sau alternative biochimice) pentru a demonstra stimularea enzimatică dependentă de prezența RPA, precum și măsurători ale lungimii telomerilor prin metode moleculare recunoscute (qPCR pentru telomeri, Southern blot pentru fragmente terminale, sau analiza prin imagistică celulară). Rezultatele coroborate au susținut concluzia că interacțiunea RPA–telomerază este relevantă biologic și funcțional în celulele umane.
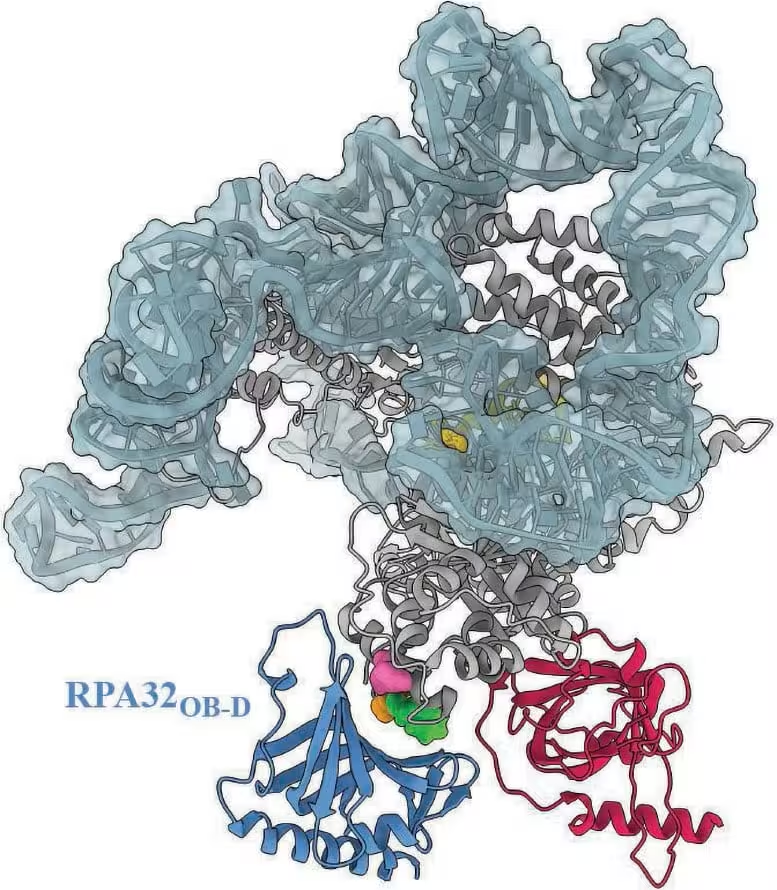
Un model al complexului telomerazei umane evidențiază zona în care RPA ar fi prezis să se atașeze. Trei variante structurale ale telomerazei, asociate pacienților cu diverse boli, sunt localizate în această zonă de andocare, sugerând că aceste variante ar putea împiedica interacțiunea RPA cu telomeraza. Credit: Ci Ji Lim
Implicații clinice: o explicație care lipsea pentru bolile cu telomeri scurți
Profesorul Lim a subliniat importanța clinică: 'Această linie de cercetare depășește înțelegerea biochimică a unui proces molecular. Ea aprofundează înțelegerea clinică a bolilor telomerice.' Echipa a demonstrat că unele variante ale telomerazei asociate bolii se localizează în interiorul sitului de legare prezis pentru RPA. Această suprapunere spațială sugerează că acele variante ar putea bloca stimularea telomerazei de către RPA, generând fenotipul de telomeri scurți, neexplicat anterior în anumite cazuri clinice.
Descoperirea oferă medicilor și geneticienilor un nou obiectiv de investigare atunci când evaluează pacienți cu scurtare inexplicabilă a telomerilor. În loc să caute exclusiv mutații în genele telomerazei (de exemplu TERT sau TR/TERC), clinicienii pot acum să verifice dacă pacientul poartă variante care perturbă interacțiunea RPA–telomerază. Aceasta poate dezvălui cauze moleculare ale tulburărilor care anterior rămâneau enigmatice, facilitând diagnosticarea moleculară și ghidarea consilierii genetice.
Pe plan clinic, aceste date încurajează extinderea panourilor de testare genetică și includerea analizelor funcționale care evaluează efectul variantelor asupra interacțiunii proteice și a activității telomerazei. Astfel, se poate trece de la o simplă identificare a variantei la o interpretare funcțională, ceea ce este esențial pentru evaluarea riscului, prognosticul și deciziile terapeutice potențiale.
Interes global și pașii următori pentru testare
Lucrarea a atras deja atenția la nivel internațional. Lim raportează solicitări din partea clinicienilor și cercetătorilor din țări precum Franța, Israel și Australia care doresc teste biochimice pentru a evalua dacă mutațiile pacienților lor afectează legarea RPA sau stimularea telomerazei. Cererea reflectă interesul pentru teste funcționale care pot completa datele obținute prin secvențiere genetică de tip NGS.
'Există pacienți cu tulburări cauzate de telomeri scurtați care nu puteau fi explicați cu cunoștințele noastre anterioare', a spus Lim. 'Acum avem o explicație pentru cauza de bază a unor mutații asociate cu telomeri scurți: rezultatul este incapacitatea RPA de a stimula telomeraza.' Prin dezvoltarea de teste biochimice standardizate, echipa poate evalua variantele identificate la pacienți și poate furniza medicilor informații despre mecanisme probabile, prognostic și posibile abordări terapeutice.
În practică, implementarea acestor teste va însemna: 1) includerea regiunilor proteinei telomerazei implicate în legarea RPA în rapoartele clinic-moleculare, 2) stabilirea de protocoale pentru evaluarea funcțională a variantelor (de exemplu teste in vitro de stimulare a telomerazei în prezența/absența RPA), și 3) orientarea pacientului către centre specializate în boli ale telomerilor pentru management și consiliere.
Unelte și tehnologii care au făcut posibilă descoperirea
Studiul ilustrează modul în care instrumentele moderne de predicție structurală, precum AlphaFold, pot ghida experimentele de laborator. Prin prioritizarea interacțiunilor candidate pe cale computațională, cercetătorii au redus semnificativ spațiul de căutare experimental, concentrându-se pe interacțiuni cu probabilitate înaltă. Apoi, aceste ipoteze au fost validate prin tehnici biochimice clasice, care au confirmat rolul funcțional al RPA în stimularea telomerazei.
Această abordare combinată accelerează tranziția de la ipoteză la insight-uri de relevanță clinică și subliniază importanța colaborării interdisciplinare între biochimiști, biologi structurali computaționali și genetici clinici. Mai mult, exemplul sugerează că integrarea inteligenței artificiale și a predicției structurale în medicina moleculară poate fi utilă pentru identificarea unor noi elemente regulatorii și pentru interpretarea variantei genetice.
Din punct de vedere tehnic, fluxul de lucru tipic include: 1) predicții structurale și de interacțiune prin AlphaFold sau alte platforme, 2) modelare moleculară pentru a identifica situsuri potențiale de legare, 3) construcții proteice reconstrucute pentru experimente in vitro, 4) teste de asociere fizică (co‑IP, pull‑down), 5) măsurători funcționale (teste de activitate telomerazică) și 6) studii celulare pentru a monitoriza lungimea telomerilor și efectele fenotipice.
Expert Insight
Dr. Elena Morales, genetician molecular neafiliată studiului, a observat: 'Legarea RPA de telomerază deschide un nou nivel de reglare pentru întreținerea telomerilor. Din punct de vedere clinic, aceasta contribuie la explicația unui subset de pacienți cu scurtare idiopatică a telomerilor. Din perspectiva terapeutică, restaurarea sau mimetizarea stimulării telomerazei de către RPA ar putea reprezenta o direcție promițătoare de explorat.'
Pe măsură ce cercetătorii extind testarea și ecranarea variantelor pacienților pentru efecte asupra interacțiunii cu RPA, diagnosticarea familiilor afectate de sindroamele telomerice scurte ar putea deveni mai rapidă. În timp, această direcție deschide posibilitatea unor strategii de tratament informate molecular — de exemplu, molecule mici care favorizează interacțiunea RPA–telomerază, peptide mimetice sau intervenții genetice care restabilească situl de legare afectat.
De asemenea, identificarea RPA ca regulator al telomerazei are implicații pentru cercetarea fundamentală: ne ajută să definim mai precis rețeaua de proteine care mențin stabilitatea genomică la capetele cromozomilor și ne oferă oportunitatea de a explora modul în care stresul replicativ, răspunsul la leziuni ADN și regenerarea telomerilor sunt integrate la nivel molecular.
În concluzie, această descoperire reprezintă un pas înainte important în biologia telomerilor, cu aplicații directe în diagnostic molecular și o potențială influență asupra dezvoltării de tratamente pentru bolile asociate cu telomeri scurtați. Integrarea predicțiilor structurale moderne cu experimente biochimice riguroase creează un model eficient pentru identificarea și validarea cofactorilor enzimatici cu relevanță clinică.
Sursa: scitechdaily

Lasă un Comentariu