9 Minute
Cercetătorii raportează o peptidă mică, proiectată, care menține proteina asociată bolii Parkinson, alfa-sinucleina, în conformația sa normală, prevenind plierea greșită și aglomerarea care sunt considerate cauze ale deteriorării neuronale. Testată într-un model simplu de vierme, molecula rezistă degradării intracelulare și nu interferează cu rolul sănătos al alfa-sinucleinei în neurotransmisie — oferind o abordare promițătoare, aflată într-o fază timpurie, pentru a opri agregarea proteică înainte ca aceasta să devină toxică.
O peptidă minusculă care fixează alfa-sinucleina
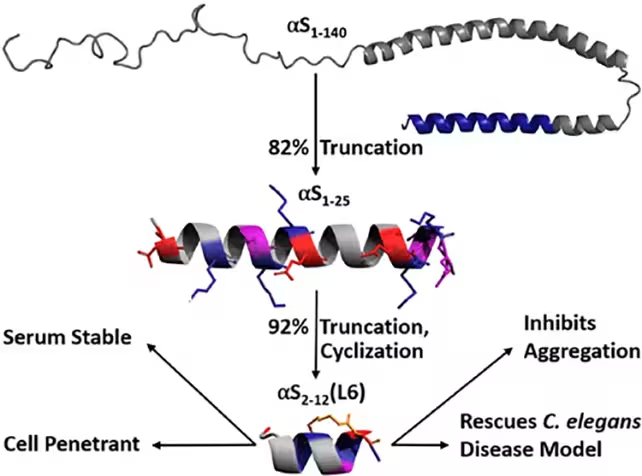
Alfa-sinucleina este o proteină neuronală mică implicată în reglarea dopaminei și a altor neurotransmițători. În boala Parkinson și în tulburări înrudite, această proteină poate suferi pliere greșită (misfolding) și se poate asambla în agregate insolubile care perturbă comunicarea neuronală și, în cele din urmă, contribuie la moartea celulară. În loc să încerce dizolvarea depozitelor deja formate, o echipă condusă de cercetători de la University of Bath a proiectat o peptidă care se leagă de alfa-sinucleină și stabilizează conformația sa sănătoasă — practic o „îngheță” înainte ca proteina să adopte o formă dăunătoare.
Abordarea a început de la un fragment mai mare de alfa-sinucleină anterior demonstrat a reduce agregarea. Cercetătorii au redus acel fragment până la secvența minimă activă și au întărit-o chimic folosind punți de lactam (lactam bridges), bucle care blochează structura peptidei și îmbunătățesc rezistența acesteia la degradarea celulară. în modelele de viermi (C. elegans) pentru boala Parkinson, această peptidă proiectată a împiedicat alfa-sinucleina să se plieze greșit, a redus formarea agregatelor toxice și a făcut toate acestea fără a provoca toxicitate celulară observabilă.
Detaliile technoști întrețin utilitatea acestui tip de intervenție: optimizarea secvenței aminocidice, introducerea de elemente chimice care sporesc stabilitatea conformațională și testele funcționale în celule vii pentru a verifica că legarea peptidei nu anulează funcțiile fiziologice normale ale proteinei țintă. Prin combinarea urmăririi structurale cu date funcționale, echipa a obținut o moleculă cu un profil promițător din punct de vedere al specificității și al stabilității intracelulare.
De ce prevenirea plierii greșite contează pentru boală
Există o distincție esențială între tratamentele care elimină agregatele și cele care le previn. Agregatele ar putea fi un efect secundar al unor procese patologice sau ar putea fi ele însele factorii care accelerează progresia bolii — separarea cauzei de consecință rămâne o provocare majoră în cercetarea neurodegenerării. O moleculă preventivă, precum peptida prezentată în acest studiu, urmărește blocarea primului eveniment din cascadele de agregare: plierea inițială greșită a moleculelor de alfa-sinucleină.
Blocarea acestui pas timpuriu poate avea beneficii practice: dacă proteina rămâne în forma sa funcțională, neuronii își păstrează capacitatea de a regla neurotransmițătorii (inclusiv dopamina), iar acumularea progresivă a unor „ghemotoace” toxice este redusă. Această strategie de stabilizare moleculară poate funcționa ca o terapie preventivă sau ca o componentă a unor regimuri combinate care includ biomarkeri pentru diagnostic precoce și intervenții farmacologice care suprimă alte mecanisme patologice.
Un unghi preventiv ar putea fi deosebit de util pentru persoanele identificate ca având risc ridicat de boală Parkinson, fie prin screening genetic (de exemplu mutații în gene asociate cu alfa-sinucleina), fie prin biomarkeri timpurii detectabili în lichidul cefalorahidian sau în imagistică. Prin menținerea alfa-sinucleinei în starea sa funcțională, celulele nervoase își păstrează homeostazia proteică și capacitatea de transmitere sinaptică, evitând totodată acumularea progresivă de depozite proteice care pot declanșa inflamație și toxicitate neuronală. Echipa de la University of Bath subliniază faptul că peptida funcționează în sisteme vii și nu perturbă rolul fiziologic al alfa-sinucleinei — o condiție-cheie pentru orice terapie care vizează o proteină abundentă, utilă în condiții normale.
Pe lângă avantajele clare în prevenție, această abordare contribuie la înțelegerea mecanistică a neurodegenerării: evidențiază situsurile critice de interacțiune (hotspots) pe molecula de alfa-sinucleină care pot fi folosite pentru designul ulterior de medicamente, fie ele peptidice sau mici molecule. Astfel de date structural-functionale pot alimenta o hartă de ținte terapeutice pentru alte strategii de modificare a bolii.
Provocări de livrare, implicații mai largi și direcții viitoare
În ciuda rezultatelor încurajatoare obținute în viermi, transformarea unei peptide stabile în celule într-o terapie umană implică multiple obstacole. Peptidele, în general, pot fi eliminate rapid din circulație, au dificultăți în traversarea barierei hemato-encefalice și pot fi recunoscute de sistemul imunitar. Munca de la Bath a abordat stabilitatea intracelulară prin modificări chimice, dar livrarea moleculă în țesutul cerebral uman, în concentrații eficiente și în siguranță, rămâne o provocare majoră de inginerie și farmacologie.
Problemele tehnice includ: obținerea unei cinetici adecvate de eliberare, reducerea clearance-ului renal și hepatic, evitarea generării de anticorpi anti-peptidă și asigurarea distribuției la regiunile cerebrale afectate (de exemplu, ganglionii bazali în boala Parkinson). Mai mult, dezvoltarea unei strategii de administrare care să permită tratament cronic (date fiind natura progresivă a bolii Parkinson) implică studii extinse de siguranță pe termen lung.
Există însă mai multe direcții tehnologice promițătoare pentru a depăși aceste bariere:
- Vectori nano-particule: încapsularea peptidei în nanoparticule biocompatibile poate proteja molecula de degradare, poate regla eliberarea și poate facilita penetrarea barierei hemato-encefalice prin mecanisme țintite.
- Peptide modificate sau conjugate: adăugarea de segmente transportoare intracelulare (cell-penetrating peptides), PEGilare parțială sau legarea la liganzi care interacționează cu receptori endoteliali din bariera hemato-encefalică.
- Administrare directă: abordări mai invazive, cum ar fi injecțiile intratecale sau perfuzia intraparenchimatoasă, pot fi folosite în stadii clinice avansate, dar prezintă riscuri și limitări practice.
- Terapie combinată: utilizarea peptidei ca parte dintr-un regim care include și terapii care reduc inflamația sau stimulează degradarea selectivă a agregatelor deja formate.
Grupul de cercetare și finanțatorii subliniază că acesta este un pas timpuriu, dar important. Julia Dudley de la Alzheimer's Research UK, care a cofinanțat studiul, a evidențiat relevanța mai largă: procese de agregare similare stau la baza demenței cu corpi Lewy și a bolii Alzheimer, iar stabilizarea conformațiilor native ale proteinelor ar putea deveni o strategie mai generală în tulburările neurodegenerative. Studiul a fost publicat în JACS Au (2025) și se bazează pe cartografiere structurală anterioară a situsurilor de interacțiune ale alfa-sinucleinei.
De remarcat este că, pentru a avansa spre aplicații clinice, următoarele etape sunt obligatorii: testare în modele mamifere relevante (șoareci transgenici sau modele mai avansate), optimizarea formulării și a strategiei de administrare, studii farmaco-toxicologice pentru a stabili doza și fenomenele adverse, precum și dezvoltarea unor biomarkeri de eficacitate care să măsoare impactul pe termen lung asupra agregării proteice și a funcției neuronale.
Din punct de vedere al reglementării, terapia bazată pe peptide necesită o clarificare a profilului de risc-beneficiu, inclusiv evaluarea potențialelor efecte off-target și posibila interacțiune cu alte medicamente utilizate în boala Parkinson. De asemenea, scalabilitatea sintezei chimice (în special când sunt folosite modificări precum punți lactamice) și protejarea proprietății intelectuale vor influența parcursul comercial și parteneriatele industriale.
Perspective expert
"Proiectarea unei peptide care este atât stabilă în interiorul celulelor, cât și selectivă pentru o formă predispusă la boală a unei proteine este un act de echilibru dificil," spune Dr. Mark Ellison, neurochimist fictiv și comunicat științific. "Acest studiu demonstrează o cale de design rațional care reduce agregarea fără a anula funcția normală a proteinei — exact tipul de specificitate de care avem nevoie pe măsură ce trecem de la organisme-model către testele clinice."
Comentariile experților subliniază două aspecte utile: întâi, necesitatea unor modele biologice care reproduc mai fidel patologia umană; al doilea, importanța unei strategii integrate care combină date structurale, biochimice și farmacologice pentru a maximiza potențialul translational al terapiilor anti-agregare. În final, selectivitatea — a nu perturba rolurile fiziologice ale proteinelor țintă — rămâne o cerință centrală în proiectarea medicamentelor.
Următorii pași ai cercetării includ testarea în modele mamifere, optimizarea strategiilor de livrare (de exemplu, purtătoare nanoparticulare sau peptide modificate care traversează bariera hemato-encefalică) și evaluarea siguranței și eficacității pe termen lung. Dacă aceste etape vor fi parcurse cu succes, peptida sau molecule înrudite ar putea deveni parte a strategiilor preventive pentru persoanele cu risc crescut de Parkinson sau alte tulburări caracterizate prin agregare proteică.
Pentru moment, studiul reprezintă un proof-of-principle: este posibil să se proiecteze rațional peptide mici care "patrulează" celulele și blochează agregarea proteică dăunătoare, lăsând în același timp biologia normală intactă — un blueprint promițător pentru abordări noi care modifică cursul bolilor neurodegenerative.
În concluzie, deși provocările de livrare și dezvoltare clinică sunt substanțiale, conceptul de stabilizare a conformației native a proteinelor prin peptide proiectate deschide un domeniu strategic în prevenția și tratamentul bolilor prin reducerea agregării proteice. Integrarea acestei strategii cu detectarea precoce (biomarkeri), terapii complementare și tehnici avansate de livrare poate conduce la soluții terapeutice cu impact semnificativ asupra evoluției bolilor neurodegenerative precum boala Parkinson și demențele asociate.
Sursa: sciencealert

Lasă un Comentariu