7 Minute
Un nou studiu de laborator de la Universitatea Aarhus indică un mecanism prin care oligomerii de alpha‑synuclein — asamblări mici ale unei proteine deja implicate în boala Parkinson — pot perfora fizic membranele celulare și pot crea pori tranzitorii. Aceste deschideri microscopice permit trecerea necontrolată a ionilor și a moleculelor mici, perturbând potențial chimia celulară și contribuind la disfuncția neuronală. Rezultatele oferă o imagine mai detaliată a modului în care agregatele proteice pot afecta celulele cerebrale și sugerează noi ținte pentru intervenție terapeutică.
Context științific: alpha‑synuclein, oligomeri și neurodegenerare
Alpha‑synuclein este o proteină neuronală normală implicată în traficul veziculelor sinaptice și eliberarea neurotransmițătorilor. În boala Parkinson aceasta se poate plia greșit și se poate acumula în fibrile mai mari cunoscute sub numele de corpi Lewy. Pe lângă aceste fibrile, sunt frecvent observate asamblări solubile mai mici, numite oligomeri — pe care mulți cercetători îi consideră deosebit de toxici. Studiul nou se concentrează asupra acestor oligomeri și asupra interacțiunii lor fizice cu bistraturile lipidice, elementul structural de bază al membranelor celulare.
Disrupția membranei indusă de oligomeri a fost propusă anterior, dar echipa de la Aarhus a folosit un model de membrană simplificat și bine controlat pentru a vizualiza procesul cu un nivel de detaliu fără precedent. Izolând această interacțiune, cercetătorii au putut înregistra schimbări etapizate care conduc de la contact la formarea porilor.
Configurația experimentală și observațiile cheie
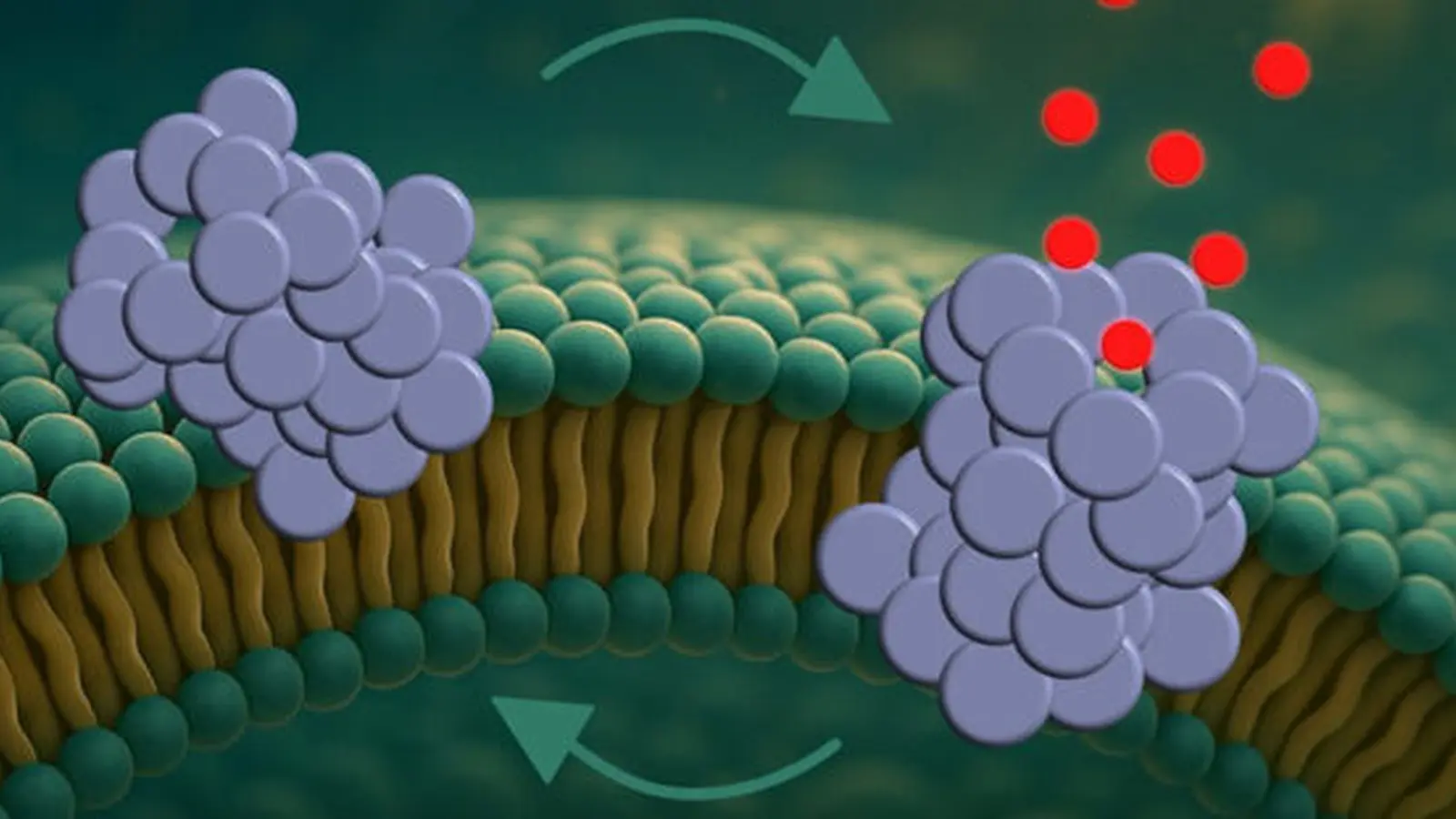
Folosind modele sintetice de membrane care imită compoziția lipidică neuronală, cercetătorii au introdus oligomeri de alpha‑synuclein în timp ce monitorizau integritatea membranei cu imagistică de înaltă rezoluție și măsurători electrice. Echipa descrie un proces în trei etape: atașarea inițială a oligomerilor la suprafața membranei, inserția parțială în bistratul lipidic și reorganizarea finală într‑o structură de tip por care străbate membrana.
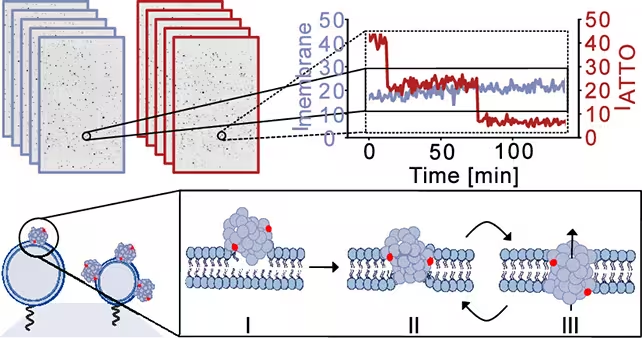
Cercetătorii au realizat instantanee ale membranelor celulare simulate pentru a urmări modul în care erau pătrunse și scurgerile produse. (Bro̷chner et al., ACS Nano, 2025)
Odată formate, porii nu erau găuri statice. În schimb, au prezentat un comportament dinamic — deschizându‑se și închizându‑se repetat pe intervale scurte. Această intermitență este importantă deoarece poate cauza fluxuri episodice de ioni care perturbă treptat homeostazia celulară, în loc să producă un eșec catastrofal imediat.
Preferința pentru curbură a membranei și vulnerabilitatea mitocondrială
O observație notabilă a fost preferința oligomerilor pentru membrane cu curburi mai pronunțate. Membranele foarte curbate sunt caracteristice organitelor intracelulare, cum ar fi mitocondriile. Mitocondriile sunt esențiale pentru producția de energie a neuronilor și pentru tamponarea calciului; dacă membranele lor sunt perforate repetat, acest lucru ar putea declanșa eșec energetic, stres oxidativ și căi ulterioare asociate neurodegenerării.
Implicații pentru mecanismele bolii Parkinson și tratament
Dacă oligomerii de alpha‑synuclein formează pori tranzitorii în membrane neuronale in vivo, aceasta ar oferi un mecanism direct prin care asamblările proteice pot provoca declin funcțional înainte de moartea celulară. Dezechilibrele ionice tranzitorii, repetate în timp, pot afecta semnalizarea sinaptică, pot perturba homeostazia calciului și pot eroda treptat reziliența neuronală. Natura dinamică și reversibilă a porilor poate explica de ce neuronii rămân adesea viabili perioade îndelungate în boala Parkinson în pofida disfuncției progresive.
Biologul molecular Bo Volf Brøchner, coautor al studiului, sugerează că deschiderea și închiderea porilor ar putea permite pompelor celulare să compenseze temporar, întârziind prăbușirea rapidă. Această fereastră compensatorie ar putea reprezenta o oportunitate pentru terapii care să restabilească echilibrul sau să blocheze formarea porilor.
Echipa de la Aarhus a investigat deja sonde moleculare numite nanocorpi — fragmente mici de anticorpi — care pot recunoaște alpha‑synuclein oligomeric după asamblare. Deși acești nanocorpi sunt utili pentru detectare, ei nu au reușit încă să prevină formarea porilor. Strategiile terapeutice viitoare ar putea urmări:
- Stabilizarea alpha‑synuclein în conformații non‑toxice
- Blocarea directă a formării porilor cu mici molecule sau anticorpi
- Protejarea sau repararea membranelor mitocondriale
- Îmbunătățirea eliminării celulare a oligomerilor prin căi de proteostază și autofagie
Limitări și pași următori
Experimentele au folosit sisteme sintetice curate pentru a izola variabile individuale. Acea claritate experimentală este un punct forte — dar rezultatele trebuie validate acum în neuroni vii și în modele animale în care compoziția membranei, partenerii proteici și mecanismele de apărare celulară sunt mai complexe. Cercetătorii trebuie să confirme dacă formarea porilor indusă de oligomeri are loc în creierul intact, cât de frecvent apare și care subtipuri neuronale sunt cele mai vulnerabile.
Munca viitoare ar trebui să cuantifice, de asemenea, dimensiunea, durata de viață și selectivitatea ionicǎ a porilor și să evalueze cum interacționează cu mecanismele celulare de reparație. Dacă sunt confirmați in vivo, acești pori ar putea deveni un biomarker măsurabil pentru stres neuronal timpuriu și o țintă pentru terapii care modifică evoluția bolii.
Expert Insight
Comentariu din partea unui neurocercetător practicant
Dr. Elena Marquez, Senior Lecturer în Neurobiologie (ficțională), comentează: "Acest studiu oferă o legătură mecanistică convingătoare între alpha‑synuclein oligomeric și disfuncția membranei. Vizualizarea etapizată a atașării, inserției și formării porilor ajută la reconcilierea toxicității biochimice cu rezultatele fiziologice — dereglarări ionice episodice, mai degrabă decât necroză imediată. Dintr‑o perspectivă translațională, provocarea este acum să demonstrăm aceste evenimente în neuroni întregi și să proiectăm molecule care fie previn asamblarea porilor, fie sigilează rapid breșele tranzitorii. Protejarea concomitentă a integrității membranei mitocondriale ar putea fi deosebit de valoroasă, având în vedere preferința oligomerilor pentru curbură."
Tehnologii conexe și perspective viitoare
Mai multe tehnologii complementare ar putea accelera translația acestor descoperiri în terapii sau diagnostice:
- Imagistică avansată în celule vii pentru a captura evenimente tranzitorii de formare a porilor în neuroni
- Biosenzori pentru fluxuri ionice și potențialul membranei mitocondriale
- Teste de mare viteză pentru mici molecule care blochează asamblarea porilor
- Rafinarea platformelor de nanocorpi pentru a neutraliza oligomerii înainte de angajarea membranei
În ansamblu, aceste abordări ar putea genera intervenții în stadii timpurii care încetinesc progresia prin prevenirea leziunilor membranare subletale repetate.
Concluzie
Studiul Universității Aarhus avansează înțelegerea bolii Parkinson arătând că oligomerii de alpha‑synuclein pot forma pori dinamici în membrane model, printr‑o succesiune de atașare–inserție–formare a porilor. Aceste breșe tranzitorii, cu o preferință observată pentru membrane curbate precum suprafețele mitocondriilor, ar putea genera perturbări ionice episodice care se acumulează în disfuncție neuronală. Deși este necesară validarea ulterioară în sisteme vii, rezultatele scot în evidență ținte mecanistice noi — de la neutralizarea oligomerilor până la protecția membranei — care pot ghida dezvoltarea viitoare de terapii și diagnostice. Cercetarea, publicată în ACS Nano, deschide o nouă direcție pentru explorarea modului în care asamblările proteice mici contribuie la neurodegenerare și cum poate fi întrerupt acest proces înainte de pierderea ireversibilă a funcției.
Sursa: sciencealert

Lasă un Comentariu