12 Minute
Impuls mitochondrial rapid ajută celulele canceroase să supraviețuiască stresului mecanic
Celulele canceroase eliberează un scurt val de energie atunci când sunt presate fizic, determinând mitocondriile să se rearanjeze în jurul nucleului și să furnizeze ATP suplimentar. Acest mecanism nou, observat atât în experimente de laborator, cât și în biopsii de la pacienți, sprijină repararea leziunilor ADN și crește șansele de supraviețuire în condiții de stres extrem.
Un studiu publicat în Nature Communications, care descrie lucrări realizate la Centre for Genomic Regulation (CRG) din Barcelona, arată că confinarea mecanică determină o creștere imediată a ATP-ului nuclear asigurat de mitocondrii. Această reacție rapidă pare să protejeze genomul atunci când celulele sunt deformate mecanic — de exemplu, în timpul traversării unor spații strânse din microambientul tumoral sau la intrarea în vasele de sânge — și ar putea reprezenta un factor până acum neobservat care contribuie la supraviețuirea și invazia celulelor canceroase.
Abordarea experimentală și observațiile principale
Cercetătorii au folosit un sistem personalizat de microscopie live-cell care comprimă fizic celule individuale până la aproximativ trei microni lățime, adică circa o treizecea parte din diametrul unui fir de păr uman. În aceste condiții de confinare, echipa a observat o rearanjare spectaculoasă a mitocondriilor în celulele canceroase HeLa cultivate: organitele s-au deplasat pentru a înconjura și chiar pentru a indentifica nucleul, formând un halou strâns pe care autorii l-au denumit mitocondrii asociate nucleului (NAMs).
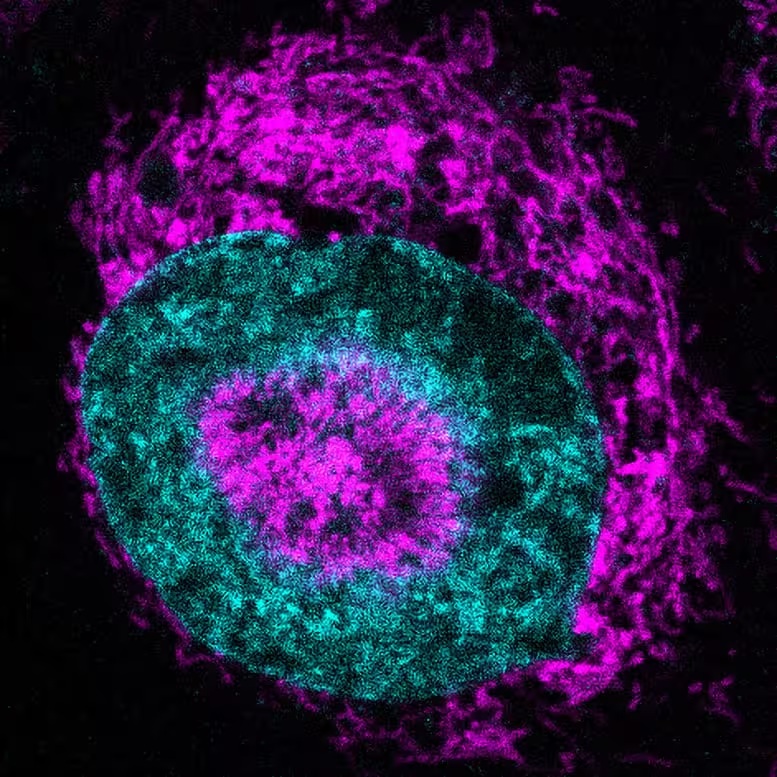
O celulă canceroasă confinată, în care mitocondriile (în magenta) se acumulează la periferia nucleară (nucleul arătat în cyan) și în „adâncituri” nucleare (indentări). Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Pentru a testa dacă această repoziționare influențează nivelurile de energie din nucleu, echipa a utilizat un senzor fluorescent de ATP țintit către nucleu. În câteva secunde de la comprimare, semnalul ATP nuclear a crescut cu aproximativ 60%. Această creștere s-a manifestat în peste 80% din celulele HeLa supuse confinării, dar a fost practic absentă în celulele necomprimare, plutitoare, indicând astfel un răspuns metabolic rapid declanșat mecanic.
Metodologic, experimentele au combinat imagistică confocală cu urmărirea timpului real a dinamicii organitelor, cuantificări statistice ale semnalelor fluorescente și controale genetice/farmacologice. Autorii au repetat observațiile în replici multiple și au folosit atât linii celulare stabilite, cât și preparate primare limitate, pentru a evalua consecvența fenotipului. Timpul foarte scurt între aplicarea forței și creșterea ATP sugerează un mecanism de repoziționare fizică mai degrabă decât o reglare transcripțională lentă.
De ce contează ATP-ul nuclear
Deformarea mecanică a nucleului generează tensiune fizică asupra cromatinei și ADN-ului. Rupturile duble de catenă și stresul topologic ale ADN-ului solicită aparate de reparare dependente de ATP — enzime și remodelatori de cromatină care au nevoie de energie pentru a accesa și reasambla regiunile afectate. Printre aceste procese se numără activitatea ligazelor de ADN, remodelarea nucleozomilor și funcționarea complexelor care repoziționează cromatina pentru a permite accesul factorilor de reparare.
Studiul a demonstrat că celulele care au beneficiat de creșterea ATP-ului mediată de NAM au reparat leziunile ADN în câteva ore și au continuat să se dividă, pe când celulele în care acest răspuns a fost atenuat nu au reușit să rezolve daunele și au prezentat un deficit de proliferare. Aceasta indică faptul că livrarea locală de ATP la nucleu nu doar compensează un deficit energetic temporar, ci influențează direct capacitatea celulei de a conserva integritatea genetică și de a progresa în ciclul celular post-traumă mecanic.
Mai mult, un furnizor punctual de ATP ar putea modula eficiența unor căi de reparare diferite (de exemplu, reparare prin recombinare homoloagă vs. non-homologă), în funcție de disponibilitatea energiei și starea cromatinei, ceea ce are implicații pentru sensibilitatea la terapii genotoxice precum radioterapia sau chimioterapia care induc rupturi de catenă.
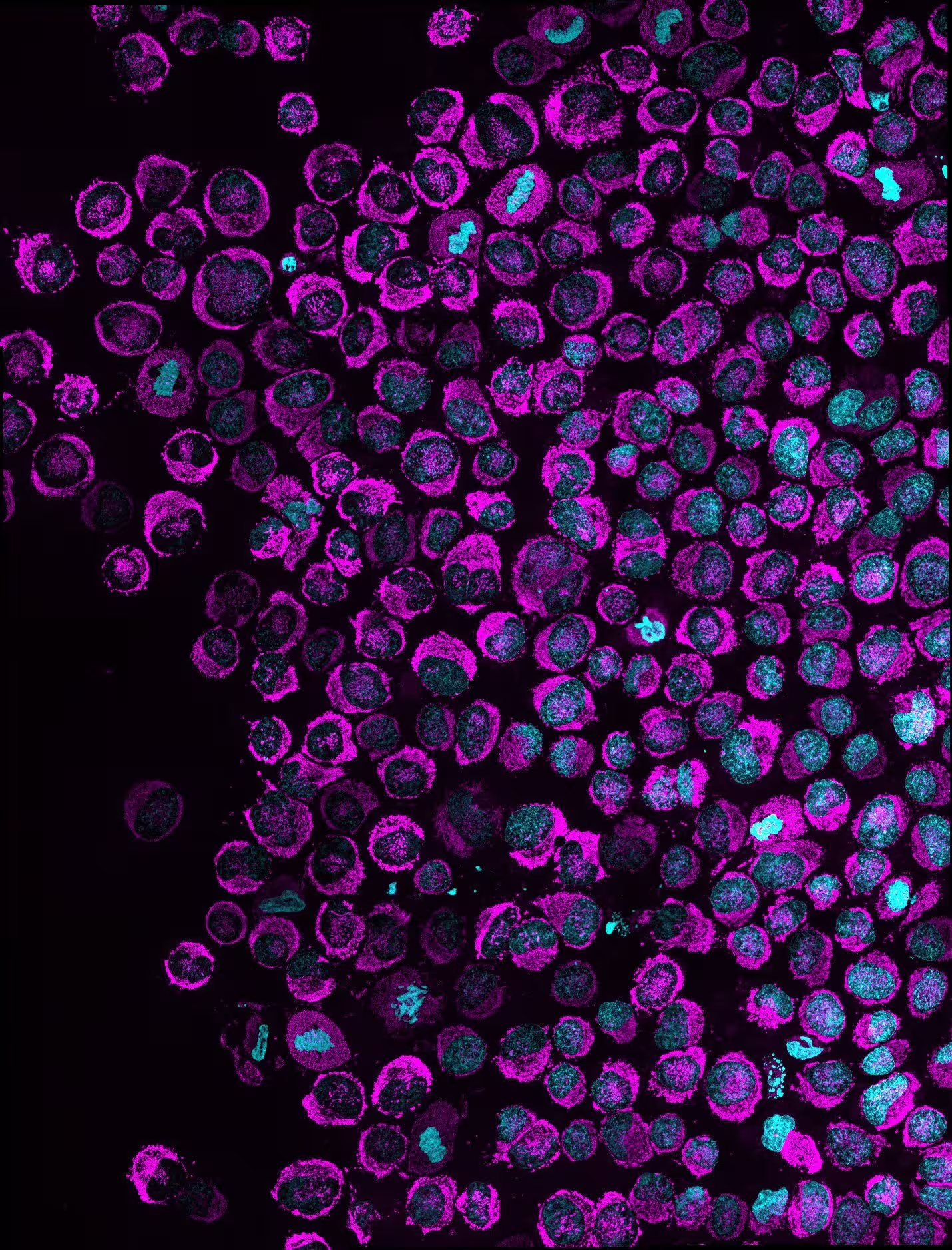
O imagine de ansamblu a mai multor celule canceroase confinate, arătând mitocondriile (în magenta) și nucleul (în cyan). Celulele în care se observă acumularea mitocondriilor în golurile nucleare prezintă fenomenul NAM. În celulele HeLa (prezentate în această imagine) penetranța fenotipului in vitro a fost de 83,6%. Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Scheletul celular care formează NAM-urile și testele farmacologice
Autorii au cartografiat structurile citoscheletale și membranare care permit mitocondriilor să se acumuleze în jurul nucleului. Filamentele de actină s-au compactat în apropierea învelișului nuclear, în timp ce reticulul endoplasmatic (RE) a creat o plasă care, împreună, au „capturat” mitocondriile la suprafața nucleară. Perturbarea actinei cu latrunculina A a demontat această schelă, a împiedicat formarea NAM și a eliminat vârful de ATP, implicând astfel rețeaua citoscheletală și contactele ER–mitocondrii în acest proces.
Pentru a conecta structura la funcție, echipa a folosit atât inhibitori farmacologici, cât și knockdown-ul unor proteine de contact ER–mitocondrie. Proteinele cunoscute pentru rolurile lor în contacte interorganelare și trafic mitocondrial — precum Mfn2, Miro sau factori de fuzie/fisură mitocondrială (Drp1, Opa1) — au fost evaluate ca potențiale componente ale mecanismului. Deși nu toate aceste proteine au fost implicate direct în formarea NAM în toate experimentele, datele sugerează că o combinație de ancorări fizice și reglementare dinamică determină eficiența repoziționării.
Această perspectivă mecanistică deschide o posibilitate terapeutică: în loc să se inhibe funcția mitocondrială în întreg organismul (ceea ce ar dăuna țesuturilor sănătoase), medicamente care perturbă selectiv schela citoscheletală sau ancorajul mitocondrial care stă la baza formării NAM ar putea reduce reziliența celulelor canceroase la stres mecanic și astfel limita invazia. Astfel de strategii ar putea viza proteine specifice ale plasei ER–mitocondrie sau elemente ale mecanismului de translocare, minimizând efectele secundare sistemice.
Autorii au menționat, de asemenea, provocările traslării clinice: multe componente citoscheletale sunt esențiale în țesuturile normale, deci selectivitatea va fi crucială. O abordare potențială este dezvoltarea de agenți care sunt activați în microambientul tumoral (de exemplu, stimuli acizi sau enzime secretate) sau livrarea locală prin nanoparticule ori anticorpi bispecifici care recunosc antigene tumorale, reducând astfel riscul de toxice off-target.
Dovezi din probe de pacienți și relevanța pentru boală
Pentru a verifica relevanța clinică, echipa a analizat biopsii mamare din 17 pacienți. Halo-urile mitocondriale asemănătoare NAM au fost mai frecvente la fronturile tumorale invazive (5,4% din nuclee) decât în nucleul dens al tumorii (1,8%), o îmbogățire de aproximativ trei ori, consistentă cu un rol în facilitarea invaziei. Deși fracțiunea totală de nuclee pozitive în țesut este mică, îmbogățirea spațială la fronturile invazive susține ideea că NAM-urile sunt activate acolo unde provocările mecanice sunt cele mai mari.
Analiza biopticelor a folosit microscopie confocală de înaltă rezoluție și cuantificare automatizată pentru a evalua frecvența și localizarea fenomenului, iar rezultatele au fost corelate cu markeri histologici de invazie și migrare celulară. Echipa a notat că, deși semnul este prezent doar la un procent relativ mic de nuclee, locația sa specifică (front invaziv) sugerează o importanță funcțională disproporționată: chiar un număr mic de celule care supraviețuiesc și păstrează genomul poate avea impact mare în progresia tumorală.
Autorii subliniază că mecanismul nu este neapărat limitat la cancer. Multe tipuri de celule se confruntă cu constrângeri mecanice — celulele imune strâmtorându-se prin noduli limfatici, neuronii migratori sau celulele care modelează embrionii — și pot utiliza o livrare locală de ATP pentru a-și păstra integritatea genomică sub stres. Astfel, NAM-urile pot reprezenta un principiu general de adaptare la stresul mecanic, cu implicații în biologie și dezvoltare, nu doar în oncologie.
Mai mult, în contexte non-tumorale, o livrare punctuală de energie poate susține funcții critice fără a altera metabolismul global al organismului — ceea ce ridică întrebări interesante despre modul în care celulele coordonează alocarea energetică la scară subcellulară în funcție de cerințele locale.
Implicații pentru metastază și pentru terapii
Această descoperire reconfigurează percepția asupra mitocondriilor: ele nu mai par doar baterii pasive ale celulei, ci răspund dinamic și pot fi mobilizate rapid către zonele cu cea mai mare nevoie. În oncologie, implicațiile sunt duble: pe de o parte, pulsațiile de ATP mediate de NAM pot ajuta celulele circulante sau invadante să supraviețuiască rigorilor mecanice ale metastazei; pe de altă parte, aparatul molecular care generează NAM-urile reprezintă o vulnerabilitate candidată.
Țintirea scheletului condus de actină, a situsurilor de contact ER–mitocondrii sau a semnalelor care declanșează repoziționarea mitocondrială ar putea reduce competența metastatică a celulelor maligne cu un potențial de toxicitate mai mic decât inhibitorii mitocondriali globali. Strategii terapeutice ar putea include inhibitori mici, peptide care blochează proteinele de ancorare, terapii bazate pe ARN care reduc expresia componentelor structurale critice sau combinații cu terapii standard pentru a spori eficiența lor (de exemplu, blocarea ATP-ului nuclear pentru a sensibiliza celulele la radioterapie).
În plus, această linie de cercetare deschide oportunități pentru dezvoltarea de biomarkeri: imagistica NAM în probe tumorale ar putea identifica pacienții cu tumori mai adaptative mecanic, care ar beneficia de terapii anti-invazie specifice. Validarea predictivității acestor markeri pentru rezultatele clinice va necesita studii paciente-cohortă mai ample și analize longitudinale.
Autorii principali și colaboratorii au subliniat schimbarea conceptuală. „Ne forțează să regândim rolul mitocondriilor în organism. Nu sunt doar baterii statice care alimentează celulele, ci mai degrabă primii respondenți agili, care pot fi chemați în situații de urgență când celulele sunt, în mod literal, puse la limită”, a declarat dr. Sara Sdelci, co-autoare corespunzătoare. Co-autorul principal, dr. Fabio Pezzano, a adăugat: „Este un semn clar că celulele se adaptează la tensiune și își rewireză metabolismul.”
Dr. Ritobrata (Rito) Ghose, co-autor principal, a observat că prezența NAM-urilor în biopsiile pacienților a consolidat relevanța clinică a descoperirii: observarea semnăturii în afara laboratorului i-a convins că fenomenul contează în tumori. Co-corelatoarea, dr. Verena Ruprecht, a sugerat că răspunsurile la stres mecanic sunt o vulnerabilitate subexplorată în biologia cancerului, care ar putea deschide noi căi terapeutice.
Perspectivă de expert
„Această lucrare leagă elegant forțele mecanice de redistribuirea energetică subcelulară și de repararea ADN”, spune dr. Elaine Morgan, biolog celular (expert fictiv) care studiază mecanica citoscheletală. „Dacă putem defini tetherii moleculare care ancorează mitocondriile în timpul confinării, ar putea fi posibil să proiectăm molecule mici sau biologice care să blocheze selectiv acea repoziționare în celulele tumorale, fără a perturba metabolismul sistemic. Ar fi un progres major pentru terapia anti-metastatică.”
Ca perspectivă practică, expertul subliniază că pașii următori includ identificarea precisă a proteinelor de ancorare, validarea în modele animale relevante și evaluarea efectelor secundare asupra țesuturilor sensibile la mecanică (cum ar fi mușchiul cardiac sau rinichiul). Această abordare trebuie să fie pragmatică: selectivitate, livrare și fenotipie clară vor decide succesul tranziției către clinică.
Concluzie
Descoperirea mitocondriilor asociate nucleului (NAM) și a capacității lor de a furniza rapid ATP sub confinare mecanică dezvăluie un nou strat de adaptare celulară. Prin livrarea de energie direct la nucleu, mitocondriile contribuie la menținerea integrității genomice în timpul stresului fizic — o funcție pe care celulele canceroase o exploatează pentru a supraviețui și a invada. Cartografierea componentelor structurale și de semnalizare ale acestui răspuns identifică ținte candidate pentru a limita metastaza, salvând totodată țesuturile normale de efecte toxice generalizate.
Muncă suplimentară va fi necesară pentru a stabili cât de răspândită este formarea NAM în diferite tipuri celulare și dacă pot fi dezvoltate inhibitori selectivi care blochează în siguranță acest comutator mecanic de supraviețuire în cancer. Studiile viitoare vor trebui să răspundă la întrebări cheie: care sunt proteinele esențiale pentru ancorarea mitocondriilor la nucleu, cum se transmite semnalul mecanic la nivel molecular și în ce măsură acest mecanism contribuie la rezistența la tratamente în probe clinice mai largi. În același timp, evaluarea consecințelor terapeutice va cere teste riguroase în modele preclinice și o atenție deosebită la selectivitatea intervențiilor.
Sursa: scitechdaily

Lasă un Comentariu