8 Minute
Cercetătorii au identificat o schimbare subtilă, legată de vârstă, în celulele care căptușesc intestinul — o redistribuire a marcajelor la nivelul ADN-ului care poate suprima treptat genele cu rol de supresie tumorală și se poate extinde pe suprafața intestinului cu mult înainte ca tumorile să apară. Experimente noi indică inflamația cronică, semnalizarea celulară alterată și dezechilibrul metabolic al fierului ca factori determinanți ai acestui proces, ceea ce contribuie la înțelegerea motivului pentru care riscul de cancer colorectal crește odată cu înaintarea în vârstă.
Cum îmbătrânirea rescrie controlul genelor în intestin
Oamenii de știință denumesc acest fenomen Aging and Colon Cancer-Associated (ACCA) drift: un model de modificări ale metilării ADN care opresc expresia unor gene fără a altera codul genetic propriu-zis. Metilarea ADN este un semn epigenetic — o etichetă chimică care indică unei celule dacă o genă ar trebui să fie activă sau supresată. În decursul a zeci de ani, aceste etichete pot să se deplaseze, să se acumuleze sau să dispară, producând un profil epigenetic „mai bătrân” în țesuturi.
Metilarea ADN implică adăugarea sau îndepărtarea grupărilor metil la nivelul siturilor CpG din regiuni importante cum sunt promotorii și enhancerii genelor. Enzime precum DNA-metil transferazele (DNMT) și demetilazele dependente de fier și cofactori (de exemplu enzimele din familia TET) reglează dinamica acestor modificări. Disfuncțiile subtile ale acestor mecanisme biochimice — fie prin influențe inflamatorii, fie prin modificări ale factorilor de creștere sau ale disponibilității cofactorilor minerali — pot modifica pe termen lung arhitectura epigenetică a epiteliului intestinal.
Prin compararea țesutului colonului sănătos provenit de la persoane de vârste diferite cu probe de tumori colorectale, echipa internațională a observat modele suprapuse de metilare. Această similaritate sugerează că aceeași schimbare epigenetică care apare în mod normal odată cu îmbătrânirea se regăsește și în țesutul canceros, indicând o cale comună prin care modificările moleculare legate de vârstă contribuie la creșterea riscului de cancer.
Unde începe deriva — și cum se extinde
Efectul își are originea în cripte intestinale, mici buzunare din mucoasa intestinală care adăpostesc celulele stem responsabile pentru reînnoirea constantă a epiteliului. Folosind probe umane, modele animale (șoareci) și organoizi cultivați în laborator (sisteme minigut), cercetătorii au urmărit ACCA drift până la modificări care apar în celulele stem din cripte. Pe măsură ce aceste cripte conduse de celule stem se divid și înlocuiesc țesutul vecin, regiunile cu un profil epigenetic „mai bătrân” și predispus la cancer se extind treptat.
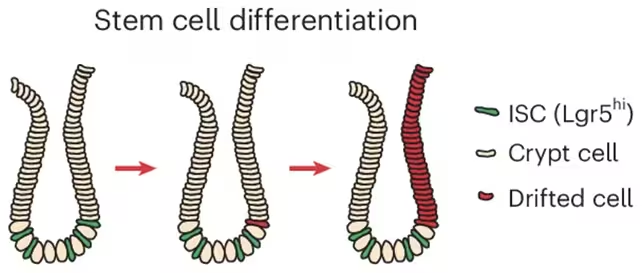
Cercetătorii au identificat modul în care celulele stem ale criptelor s-au schimbat și s-au răspândit.
Mai mulți factori converg pentru a perturba întreținerea normală a marcajelor de metilare: inflamația cronică la nivelul intestinului, semnalizarea redusă a factorilor de creștere și scăderea concentrației intracelulare de fier. Când sistemele de reparare dependente de fier nu mai funcționează optim, marcajele de metilare eronate persistă și genele care în mod normal suprimă tumorigeneza pot fi treptat suprimate. Acest proces nu mai este doar local, ci se poate propaga prin procese fiziologice normale cum ar fi fuzionarea sau diviziunea criptelor (crypt fission), ceea ce explică extinderea pe suprafețe tot mai mari ale mucoasei colonice.
În modele experimentale, cercetătorii au combinat tehnici moleculare avansate: secvențierea epigenomică la nivel unic de celulă, trasare liniară a descendenților (lineage tracing), transcriptomică și manipulări biochimice care afectează aportul de fier sau axele de semnalizare celulară (de exemplu semnalizarea Wnt, Notch sau factori de creștere locali). Această abordare integrată a permis identificarea clară a originii schimbărilor epigenetice în celulele stem ale criptelor și modul în care aceste schimbări sunt propagate în timp.
De ce contează inflamația și fierul
- Inflamația emite semnale pro-inflamatorii (citokine, chemokine) care supun celulele stem la stres oxidativ și perturbă mecanismele de întreținere epigenetică, favorizând acumularea de modificări erratice.
- Reducerea semnalizării de creștere (de exemplu scăderea semnalului Wnt sau perturbarea axelor de reglare epidermală) limitează capacitatea celulară de a repara sau înlocui modelele epigenetice defecte, facilitând stabilirea unui profil „îmbătrânit”.
- Insuficiența fierului intracelular afectează enzimele dependente de Fe(II), precum demetilazele TET, care sunt esențiale pentru eliminarea metilărilor aberante; astfel, marcajele dăunătoare se acumulează, sporind riscul de inactivare a genelor supresoare tumorale.
„Observăm un tipar epigenetic care devine din ce în ce mai evident odată cu înaintarea în vârstă,” a spus Francesco Neri de la Universitatea din Torino, subliniind legătura dintre deriva lentă a metilării și susceptibilitatea ulterioară la cancer. Anna Krepelova, tot din Torino, a adăugat că diviziunea criptelor acționează ca un mozaic cu creștere lentă: „Prin procesul natural de diviziune a criptelor, aceste regiuni se măresc continuu și pot continua să crească pe parcursul multor ani.”
Importanța acestui lucru constă și în faptul că deriva ACCA nu pare a fi întotdeauna ireversibilă. Experimentele în organoizi au arătat că restabilirea captării de fier sau reactivarea unor semnale de creștere specifice a încetinit — și în unele cazuri a inversat parțial — îmbătrânirea epigenetică observată în celulele stem ale criptelor. Această reversibilitate indică posibilitatea ca procesele moleculare care stau la baza îmbătrânirii și a riscului de cancer să fie modificate prin intervenții direcționate.
Din punct de vedere mecanistic, intervențiile care restabilesc un echilibru redox adecvat, care optimizează furnizarea de cofactori (de exemplu fierul în starea chimică activă Fe(II) necesară demetilazelor) sau care atenuează semnalizarea inflamatorie (prin modularea NF-κB și a căilor downstream) pot influența dinamica metilării. Totuși, aceste direcții necesită validare riguroasă în studii preclinice și clinice pentru a confirma beneficiile și securitatea oricăror strategii terapeutice sau preventive.
Implicații pentru prevenție și cercetare viitoare
Studiul reconfigurează perspectiva asupra riscului de cancer colorectal: nu mai este privit doar ca un rezultat al acumulării de mutații în ADN, ci și al schimbărilor epigenetice progresive, la scară celulară, care se extind peste suprafața intestinală. Această repunere în context deschide perspective pentru strategii preventive noi care să vizeze inflamația, metabolismul fierului și semnalizarea celulară în nișa celulelor stem intestinale. Detectarea timpurie a zonelor epigenetice „periculoase” (methylation danger zones) ar putea, în viitor, să completeze metodele actuale de screening, precum colonoscopia sau testele fecale pentru sânge ocazional (FOBT) și testele bazate pe ADN liber circulant (cfDNA).
Tehnologiile moleculare în dezvoltare permit acum profilarea metilomului la nivelul probelor minime (de exemplu ADN fecal sau ADN tumoral circulant), iar biomarkerii epigenetici specifici deriva ACCA ar putea fi integrați în panouri de screening noninvazive. De asemenea, monitorizarea longitudinală a pacienților cu boli inflamatorii intestinale (IBD) sau cu alte condiții care predispun la inflamație cronică ar putea include evaluări epigenetice pentru a identifica timpurii «zone de risc» și pentru a urmări eficacitatea intervențiilor antiinflamatorii.
La nivel de cercetare, înțelegerea factorilor determinanți și a interacțiunilor moleculare oferă ținte clare: enzime epigenetice (DNMT, TET), căi de semnalizare (Wnt, Notch, EGFR), reglatori ai homeostaziei fierului (transferrina, DMT1, ferritina) și componente ale răspunsului inflamator (NF-κB, IL-6, TNF). Aceste ținte pot fi testate în modele preclinice ca potențiale ținte terapeutice sau preventive. De asemenea, variabilitatea interindividuală — influențată de factori genetici, nutriționali, microbiom și expuneri de mediu — va dicta ritmul deriva ACCA, motiv pentru care abordările personalizate vor fi importante.
Publicat în Nature Aging, acest corp de lucrări adaugă o nouă dimensiune biologiei îmbătrânirii — una care poate fi încetinită sau modulată pentru a reduce riscul pe viață de cancer colorectal. Următorii pași includ validarea biomarkerilor epigenetici în cohorte mari, dezvoltarea de terapii care să vizeze mecanismele identificate și evaluarea impactului intervențiilor asupra incidenței reale a cancerului în studii clinice controlate.
Din perspectivă clinică și publică, aceste descoperiri sugerează câteva direcții practice de interes: management optim al inflamației intestinale pentru pacienții cu IBD, reevaluarea strategiilor de suplimentare cu fier în anumite contexte clinice (pentru a înțelege efectele asupra enzimelor epigenetice), și dezvoltarea de programe de screening care să includă markeri epigenetici sensibili la schimbările precoce. Orice modificare a practicilor clinice va necesita însă dovezi solide privind eficacitatea și siguranța, pentru a evita intervenții nejustificate.
În concluzie, această cercetare nu numai că clarifică un mecanism molecular important prin care îmbătrânirea crește riscul de cancer colorectal, dar și motivează dezvoltarea unor strategii combinate — antiinflamatorii, metabolice și de reglare a semnalizării celulare — care, împreună cu screening-ul epigenetic, ar putea reduce povara bolii.
Sursa: sciencealert

Lasă un Comentariu