10 Minute
Un nou studiu sugerează că ficatul poate fi determinat să restabilească temporar funcții imunitare specifice tinereții prin producerea unor semnale în mod normal sintetizate de timus. La șoareci, un tratament țintit cu mRNA a reactivat producția de celule T și a îmbunătățit răspunsurile la vaccinuri și la tumori — o cale potențială către o reîntinerire imună mai sigură pentru adulții în vârstă. Studiul oferă o abordare inovatoare de modulare organ-specifică a imunității, cu implicații pentru vaccinologie, imunoterapie și sănătatea populațiilor vârstnice.
Celulele T sunt o componentă esențială a sistemului imunitar al organismului și determină multe răspunsuri la infecții și tumori.
De ce contează timusul — și ce se strică odată cu înaintarea în vârstă
Timusul este un organ mic, situat imediat deasupra inimii, care instrucționează celulele imature pentru a deveni celule T funcționale, verigile de bază ale imunității adaptative. În perioada de tinerețe și până la începutul maturității, timusul este activ, generând un flux constant de celule T naive, capabile să recunoască antigene noi. Însă, începând din adultul tânăr, timusul suferă un proces de involuție timică — se micșorează și își reduce treptat activitatea.
Ca urmare, la persoanele în vârstă apar două probleme principale: producția de celule T naive scade, iar diversitatea repertoriului de receptor al celulelor T se reduce. Această pierdere de diversitate imunologică contribuie la o scădere a eficacității vaccinurilor, o susceptibilitate mai mare la infecții și la o capacitate redusă de supraveghere a tumorilor. În literatura de specialitate aceste fenomene fac parte din conceptul mai larg de imunosenescență, iar ele explică parțial de ce populațiile vârstnice prezintă rate mai mari de boală infecțioasă și răspunsuri vaccinale mai slabe.
Cercetătorii de la Broad Institute al MIT și Harvard și-au propus să înlocuiască doar anumite funcții de semnalizare ale timusului, în loc să încerce regenerarea completă a organului. Strategia lor a fost să folosească ficatul — un organ robust care continuă să producă proteine chiar și la vârste înaintate — pentru a secreta acele semnale moleculare (citokine și liganduri) care favorizează dezvoltarea și supraviețuirea celulelor T. Abordarea urmărește o „reparație funcțională” temporară, concept relevant pentru terapiile care vizează reîmprospătarea sistemului imunitar fără intervenții invazive majore.
Transformarea ficatului într-o fabrică de proteine asemănătoare timusului
Mai întâi, echipa a comparat sistemele imunitare ale șoarecilor tineri și bătrâni pentru a identifica semnalele cheie care scad odată cu vârsta. Analizele au evidențiat o scădere a unor factori esențiali pentru direcționarea destinului celular și pentru menținerea sănătății celulelor T aflate în dezvoltare. În mod particular, cercetătorii s-au concentrat pe trei proteine cu rol central: DLL1 (Delta-like ligand 1), FLT3-L (ligandul receptorului FLT3) și IL-7 (interleukina 7). Aceste trei factori acționează ca instrucțiuni moleculare care încurajează celulele progenitoare să se diferențieze în celule T și să rămână viabile și funcționale.
Rolurile moleculare ale acestor factori sunt complementare: DLL1 este implicat în semnalizarea Notch, esențială pentru alegerea destinului limfoid; FLT3-L susține expansiunea și supraviețuirea progenitorilor limfoizi; iar IL-7 este un factor critic pentru supraviețuirea și homeostazia celulelor T naive și a celor cu memorie. Combinarea lor vizează părți diferite ale rutelor de diferențiere și de menținere a celulelor T, oferind un set coerent de indicații moleculare asemănătoare celor produse de timus.
mRNA livrează instrucțiunile
Următorul pas a fost împachetarea informației genetice sub forma ARN mesager (mRNA) care codifică aceste proteine de semnalizare și administrarea lor direct în ficatul șoarecilor îmbătrâniți, repetat pe parcursul mai multor săptămâni. mRNA funcționează ca un plan temporar prin care celulele produc proteinele dorite — aceeași platformă tehnologică utilizată în vaccinurile pe bază de mRNA — și permite ficatului să sintetizeze DLL1, FLT3-L și IL-7 fără a modifica permanent țesutul.
Livrarea mRNA în ficat se face, în mod obișnuit, prin vehicule lipidice sau alte sisteme de livrare care protejează moleculele și facilitează intrarea lor în hepatocite. Această metodă permite o exprimare temporară și controlabilă a factorilor, oferind posibilitatea de a întrerupe terapia dacă apar efecte nedorite. Prin menținerea producției la nivel hepatic, semnalele sunt eliberate în circulație localizată și pot influența progenitorii limfoizi din măduva osoasă și organele limfoide, imitând parțial fluxul de citokine produse în mod fiziologic de timus.
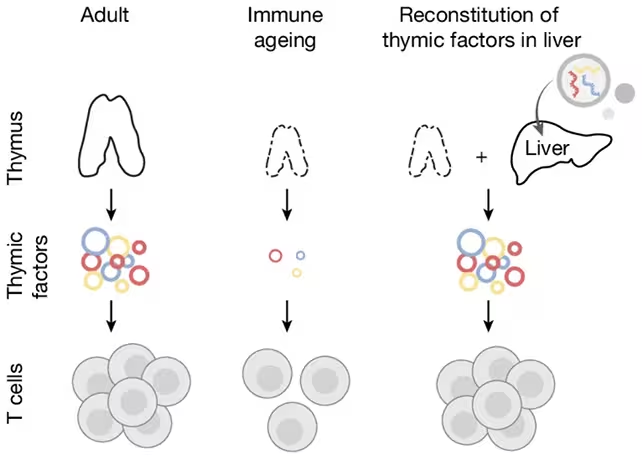
Cercetătorii au folosit ficatul șoarecilor pentru a stimula producția de celule T și a observa efectele asupra imunității.
Celule T mai puternice și mai diverse — dar doar temporar
După patru săptămâni de tratament, șoarecii în vârstă au arătat îmbunătățiri clare și măsurabile: creșterea numărului de celule T, o diversitate crescută a repertoarului de celule T, răspunsuri antibod eficiente la vaccinare și o capacitate mai bună de control al tumorilor în testele experimentale de provocare tumorală. În esență, profilul lor imun a prezentat caracteristici asociate cu un sistem imunitar mai „tânăr” și mai rezilient.
Un aspect important al rezultatelor a fost natura tranzitorie a efectului. Exprimarea hepatică crescută a factorilor a scăzut după întreruperea tratamentului, iar parametrii imunologici au revenit treptat spre nivelele anterioare. Autorii subliniază că această caracteristică este, de fapt, un avantaj din perspectiva siguranței: o creștere temporară a producției de celule T reduce riscul de supra-stimulare cronică a sistemului imunitar, fenomen care poate declanșa inflamație persistentă sau reacții autoimune nedorite.
Această „reînnoire funcțională” temporară poate fi utilă clinic în situații bine definite: de exemplu, pentru a mări fereastra de răspuns imun la un vaccin administrat persoanelor în vârstă sau ca terapie adjuvantă în combinație cu imunoterapiile împotriva cancerului. Modelul permite controlul duratei și intensității semnalizării, oferind o marjă de manevră pentru optimizarea raportului beneficiu-risc.
Ce înseamnă pentru sănătatea umană și pașii următori
Rezultatele la șoareci indică o alternativă promițătoare la strategiile sistemice de stimulare a imunității care inundă fluxul sanguin și pot cauza efecte adverse. Fiind un organ care filtrează sângele și care este relativ accesibil terapiilor țintite, ficatul poate servi ca un site de livrare practic pentru o modulare imună controlată, specifică unui organ. Aceasta reduce expunerea sistemică necontrolată și ar putea limita efectele secundare.
Totuși, succesul la modele murine nu garantează beneficii directe la oameni. Există diferențe importante între sistemul imunitar al șoarecilor și cel uman, inclusiv în distribuția celulelor progenitoare, în dinamica timică și în modul cum anumite citokine funcționează. De aceea, cercetătorii intenționează să testeze abordarea în alte modele animale mai apropiate de fiziologia umană, să rafineze combinația și doza factorilor de semnalizare și să evalueze efectele asupra altor tipuri de celule imune (de ex. celule B, celule dendritice) și a microambientului tumoral.
Translarea clinică va necesita o documentare atentă a parametrilor de dozare, a frecvenței administrării, a profilului de siguranță pe termen scurt și lung și a posibilelor interacțiuni cu alte medicamente sau condiții medicale frecvente la persoanele vârstnice. Reglementatorii vor solicita date robuste privind toxicitatea, riscul de imunogenitate la componentele de livrare (de ex. nanoparticule lipide) și monitorizarea pentru semne de autoimunitate sau inflamație cronică.
Din punct de vedere aplicativ, o terapie mRNA hepatică validată la oameni ar putea fi utilizată în mai multe scenarii: augmentarea eficacității vaccinurilor sezoniere sau a celor antigripale la persoane în vârstă, sprijinirea răspunsului imun înainte sau după operații în care riscul infecțiilor este crescut, sau ca adjuvant al tratamentelor oncologice pentru a îmbunătăți recunoașterea și eliminarea celulelor tumorale. De asemenea, ar putea fi explorată o utilizare ciclică, administrându-se tratamentul în perioade planificate pentru a menține un nivel optim de protecție imună fără expunere permanentă la semnale pro-inflamatorii.
În interviuri legate de rațiunea strategiei, Mirco Friedrich (Broad Institute/MIT) a explicat: „Ne-am propus să menținem protecția imună mai departe în viață imitând secrețiile timice.” Feng Zhang (MIT) a descris metoda ca pe o soluție sintetică, cu gândire inginerească, pentru a recrea semnalele timice fără a reconstrui timusul însuși. Aceste perspective subliniază orientarea practică a cercetării: replicarea funcțiilor critice ale unui organ printr-un alt organ accesibil, reducând complexitatea regenerării organelor în sine.
Dacă rezultatele se vor confirma la oameni, o terapie mRNA bazată pe ficat ar putea deveni un instrument util pentru atenuarea declinului imun legat de vârstă, cu potențialul de a îmbunătăți eficacitatea vaccinurilor și rezistența la boli în rândul adulților vârstnici, evitând unele riscuri asociate intervențiilor care acționează direct în circulație. Totuși, dezvoltarea clinică va fi graduală și va necesita colaborări strânse între imuno-biologi, ingineri de terapie genică, clinicieni geriatri și autorități de reglementare.
Pe lângă pașii experimentali, mai sunt și considerații etice și logistice: alegerea populațiilor vizate pentru studii clinice (de ex. persoane cu imunitate compromisă vs. populație generală vârstnică), balanța între beneficiu și riscurile potențiale în subgrupuri cu comorbidități, și accesibilitatea viitoarelor terapii. În plus, se impune o supraveghere atentă a posibilității ca reactivarea imunității să influențeze stări inflamatorii sau boli autoimune preexistente.
În concluzie, studiul oferă un exemplu convingător de „inginerie a imunității” prin redirecționarea funcțiilor organelor, demonstrând că este posibil să restimulăm în mod controlat anumite componente ale sistemului imunitar la vârstnici. Direcțiile viitoare includ optimizarea combinațiilor de semnale (de ex. ajustarea raportului DLL1:FLT3-L:IL-7), definirea duratei și intermitenței administrării și evaluarea efectelor pe termen lung asupra repertoriului de celule T și a sănătății generale. Dacă aceste etape vor fi parcurse cu succes, terapia mRNA hepatică ar putea completa instrumentarul pentru îmbunătățirea sănătății imunologice la populațiile îmbătrânite.
Sursa: sciencealert

Lasă un Comentariu