8 Minute
O nouă analiză genetică sugerează că creşterile mai mari ale glicemiei în primele două ore după masă — cunoscute frecvent ca vârfuri glicemice postprandiale sau glucoză post-load la 2 ore (2hPG) — pot fi asociate cu un risc semnificativ mai mare de dezvoltare a bolii Alzheimer. Această descoperire adaugă nuanţă unei imagini complexe care leagă diabetul, funcţia insulinei şi demenţa şi indică controlul glicemiei după masă ca un potenţial punct de intervenţie pentru prevenţie. Studiul aminteşte importanţa monitorizării glicemiei postprandiale în contextul sănătăţii cognitive şi sugerează ipoteze noi despre legătura dintre metabolizarea glucozei şi patologia neurodegenerativă.
Ce a făcut studiul și ce a găsit
Cercetătorii din Regatul Unit au examinat date genetice provenite de la 357.883 de persoane pentru a investiga dacă genele care predispun indivizii la un nivel mai ridicat de glucoză post-load la 2 ore (2hPG) cresc de asemenea probabilitatea de a dezvolta boala Alzheimer la o vârstă ulterioară. În loc să măsoare glicemia direct în cadrul participanţilor, echipa a folosit randomizarea mendeliană (Mendelian randomization), o metodă epidemiologică care valorifică variantele genetice moştenite ca proxy pentru expunerea pe parcursul vieţii la un anumit caracter — în acest caz, tendinţa de a avea vârfuri glicemice după mesele principale. Fiindcă variaţia genetică este stabilită la concepţie şi nu este influenţată de stilul de viaţă ulterior sau de apariţia bolilor, randomizarea mendeliană reduce anumite tipuri de confuzie şi întăreşte inferenţele cauzale.
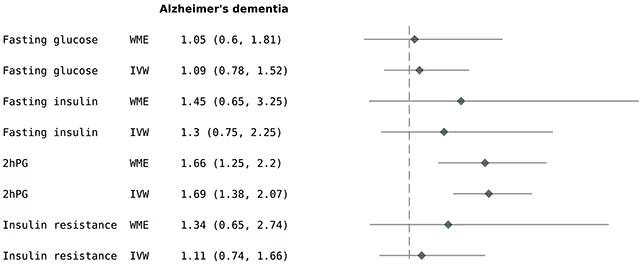
Analiza statistică a arătat că predispoziţia genetică către valori mai mari ale 2hPG a fost asociată cu un risc crescut de aproximativ 69% pentru boala Alzheimer. Rezultatul sugerează o corelaţie robustă în setul de date analizat, însă este important de subliniat că estimarea se bazează pe indicatori genetici şi pe modele statistice specifice. Surprinzător, studiul nu a identificat asocieri similare între glicemia de repaus (fasting glucose), nivelurile bazale de insulină sau măsuri largi ale rezistenţei la insulină şi riscul de Alzheimer sau demenţă în general. Această constatare indică faptul că ar putea fi acele creşteri tranzitorii ale glicemiei post-meal, mai degrabă decât hiper glicemia cronică de bază sau rezistenţa insulinică generală, care sunt relevante pentru riscul cognitiv observat în acest set de date.
Metode, imagistică cerebrală și întrebări rămase
O parte din participanţi au avut disponibile şi investigaţii imagistice cerebrale; aceste date au permis echipei să verifice dacă trăsăturile glicemice sau insulinice se corelează cu modificări structurale evidente, cum ar fi volumul hipocampului sau leziunile substanţei albe. Imaginile cerebrale nu au arătat legături clare între trăsăturile metabolice studiate şi modificări structurale notabile, cum ar fi reducerea marcată a volumului hipocampal sau o creştere semnificativă a leziunilor materiei albe. Aceasta sugerează că legătura dintre glucoza postprandială şi Alzheimer ar putea funcţiona prin căi metabolice sau inflamatorii mai subtile, prin disfuncţii la nivel sinaptic, sau prin efecte vasculare mici care nu se manifestă imediat ca pierdere tisulară masivă detectabilă prin RMN standard.
Asemenea observaţii ridică întrebări esenţiale despre mecanismele biologice implicate. Creierul utilizează glucoza drept combustibil principal, astfel încât stresul metabolic repetat după mese, inflamaţia microglială sau stresul oxidativ la nivel neuronal ar putea, în mod plauzibil, să se acumuleze în timp şi să contribuie la degenerare. Totuşi, cascadele moleculare exacte — cum ar putea transformările glicemice pe termen scurt în acumulări patologice tipice Alzheimer, cum ar fi plăcile de amiloid, încurcăturile de tau sau disfuncţia sinaptică — rămân încă neclare. Sunt propuse mai multe ipoteze: modificări ale permeabilităţii barierei hemato-encefalice, glicare avansată a proteinelor (AGEs), activare microvasculară şi inflamaţie cronică de grad mic care afectează clearance-ul proteinelor toxice sau promovează disfuncţii sinaptice înainte de pierderi tisulare evidente.
De ce contează randomizarea mendeliană
- Randomizarea mendeliană reduce erorile cauzate de factori de viaţă şi de cauzalitatea inversă, folosind variantele genetice ca experimente naturale care imită un design de tip „instrumental variable”.
- Dacă predispoziţia genetică la valori mai mari de 2hPG creşte riscul de boală, acest lucru susţine ipoteza unui rol cauzal potenţial al creşterilor glicemice postprandiale în patogeneza Alzheimer.
- Totuşi, rezultatele genetice necesită replicare în cohorte diverse, analize complementare şi studii funcţionale care să cartografieze mecanismele moleculare şi celulare implicate. Validarea în populaţii multietnice şi abordări experimentale (modele animale, studii interventionale) sunt paşi esenţiali pentru transformarea acestor semnale într-un corp de dovezi aplicabil clinic.
Conducătorul echipei de epidemiologie, Andrew Mason (University of Liverpool), subliniază implicaţiile practice: gestionarea glicemiei ar putea necesita un grad mai mare de nuanţare decât simpla monitorizare a valorilor de repaus — controlul vârfurilor glicemice după mese ar putea conta pentru sănătatea creierului pe termen lung. Epidemiolog genetic Vicky Garfield, tot de la Liverpool, avertizează că replicarea este esenţială, mai ales în populaţii mai diverse decât cele predominante în setul de date original. Amândoi accentuează necesitatea unor studii clinice care să evalueze dacă reducerea activă a glicemiei postprandiale poate modifica cursul cognitive sau incidenţa demenţei.
Limitări și perspectivă de sănătate publică
Setul principal de date — extras din UK Biobank — are anumite limitări care afectează generalizarea rezultatelor: eşantionul tinde să fie mai sănătos şi provine, în proporţie covârşitoare, dintr-o populaţie de origine White British cu statut socio-economic mai ridicat. Acest lucru poate introduce bias de selecţie şi poate face dificilă extrapolarea rezultatelor către populaţii cu distribuţii diferite ale factorilor de risc, medii socioeconomice sau ancestrii genetici. În plus, echipa nu a reuşit să reproducă descoperirea într-un set genetic mai vechi şi mai mic, compus din 111.326 de persoane; diferenţele în selecţia participanţilor, în definirea fenotipurilor, sau în puterea statistică pot explica discrepanţa. Prin urmare, legătura observată este interesantă, dar provizorie până la confirmarea pe baze mai largi şi în cohorte independente.
Pentru clinicieni şi public, studiul întăreşte sfaturile deja consacrate: reducerea variaţiilor mari ale glicemiei după mese poate aduce beneficii pentru sănătatea cardiovasculară şi metabolică şi, posibil, să influenţeze riscul de demenţă. Măsuri practice care reduc vârfurile glicemice includ alegerea unor mese echilibrate bogate în fibre, proteine şi grăsimi sănătoase pentru a tempera absorbţia carbohidraţilor, preferarea carbohidraţilor cu indice glicemic scăzut, controlul porţiilor şi evitarea zaharurilor rafinate. Activitatea fizică uşoară sau moderată efectuată la scurt timp după masă poate ajuta la diminuarea spike-urilor glicemice prin creşterea captării glucozei de către muşchi, iar managementul medical — inclusiv ajustarea tratamentelor antidiabetice la pacienţi selectaţi sau utilizarea agenţilor farmacologici care atenuează vârfurile postprandiale — poate fi luat în considerare în contexte clinice adecvate, în urma unei evaluări individualizate.
Important de remarcat este că, înainte ca astfel de recomandări să devină directive de sănătate publică pentru prevenţia Alzheimer, este nevoie de dovezi din studii de intervenţie: doar reducerea măsurată a glucozei postprandiale trebuie legată direct de scăderea incidenţei demenţei într-un mod reproductibil. În plus, strategiile de sănătate publică ar trebui să fie echitabile şi adaptate diverselor populaţii, având în vedere predispoziţiile genetice variabile şi factorii socio-economici care influenţează alimentaţia şi accesul la îngrijire medicală.
Pe măsură ce domeniul progresează, cercetătorii vor trebui să reproducă aceste semnale genetice în populaţii cu diferite ancestrii, să urmărească mecanismele celulare din creier care leagă metabolismul glucozei de procesele neurodegenerative şi să deruleze studii interveneţionale care țintesc explicit reducerea vârfurilor glicemice postprandiale pentru a testa dacă astfel se poate diminua riscul de demenţă. Explorarea acestor conexiuni are potenţialul de a genera noi recomandări clinice şi strategii de prevenţie care să includă controlul glicemiei postprandiale ca parte a intervenţiilor pentru sănătatea cognitivă pe termen lung.
Sursa: sciencealert


Lasă un Comentariu