9 Minute
Descoperire: enzimă declanșează colapsul ADN tumoral
Cercetătorii de la University of California San Diego au identificat enzima care declanșează chromothripsis — un eveniment catastrofal unic în care un cromozom se sfărâmă și se reasamblează într-o ordine aleatorie, distructivă. Acest tip de haos genomic accelerează evoluția rapidă a tumorilor, favorizează apariția rezistenței la medicamente și contribuie la explicarea motivului pentru care anumite cancere se comportă ca mașini de mare performanță forțate dincolo de limitele proiectării lor.
Ce a descoperit echipa
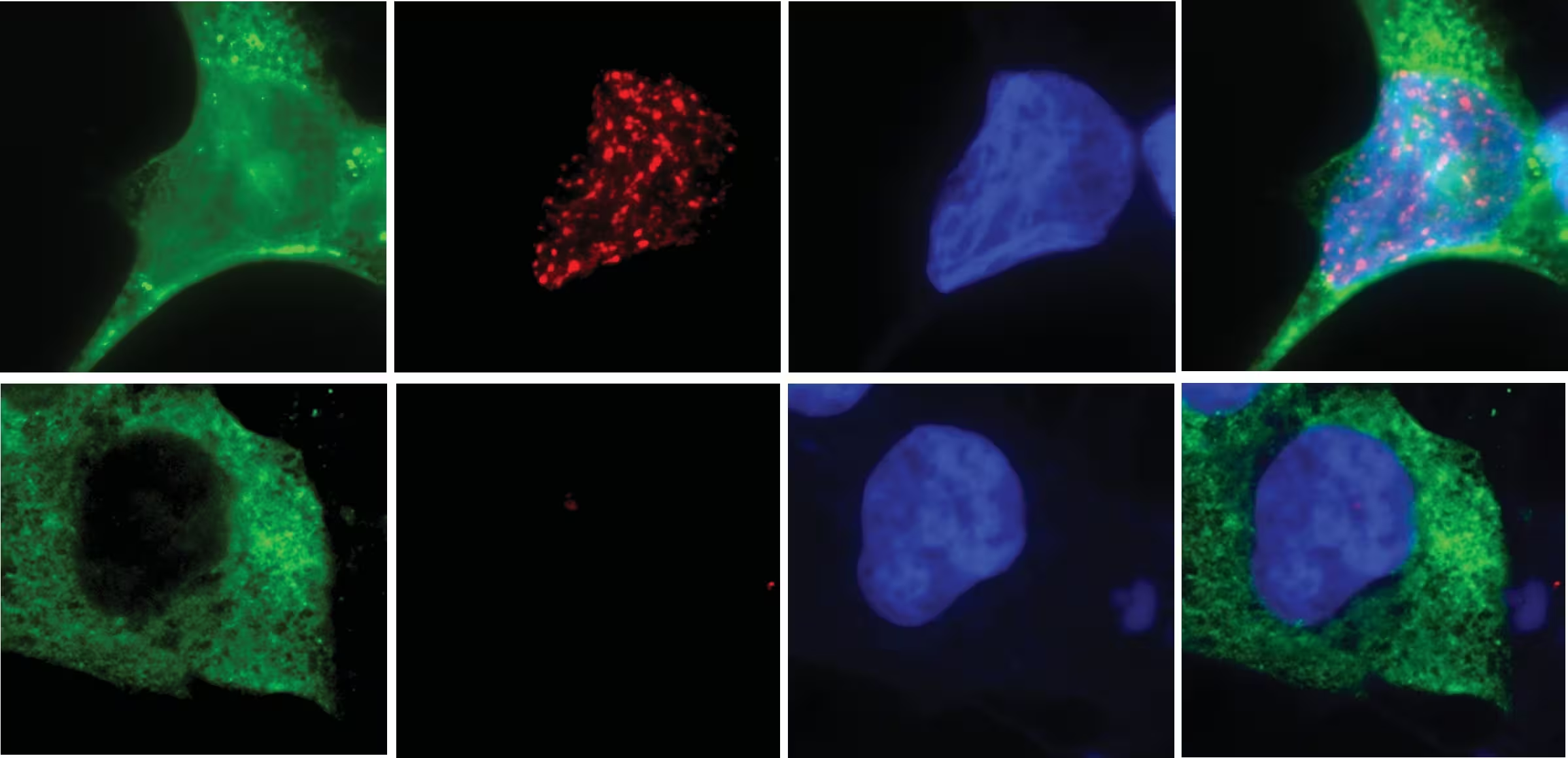
Folosind imagistică în celule vii și o cribă sistematică a nucleazelor umane cunoscute sau prezise, grupul de la UC San Diego a identificat N4BP2 ca instigatorul molecular capabil să pătrundă în micronuclee fragile și să fragmenteze ADN-ul. Eliminarea N4BP2 din celulele canceroase reduce în mod dramatic sfărâmarea cromozomilor. În schimb, forțarea enzimei în nuclee intacte duce la numeroase rupturi ale ADN-ului, chiar și în celule altminteri sănătoase. Rezultatele, publicate în Science, clarifică un mister de peste un deceniu în genomica cancerului.
De ce contează chromothripsis
Chromothripsis se distinge de acumularea lentă de mutații la care majoritatea se gândesc. În locul unui proces gradual, zeci sau sute de rearanjamente pot apărea într-un singur episod, ceea ce accelerează dobândirea trăsăturilor agresive de către o tumoră. Estimările actuale sugerează că aproximativ unul din patru cancere umane poartă urmele moleculare ale chromothripsis, cu o prevalență crescută în osteosarcom și în multe tumori cerebrale.
O analogie utilă este cea a unei mașini care suferă un impact masiv: șasiul se fracturează, componentele aftermarket se amestecă și, dintr-o dată, performanța și manevrabilitatea devin imprevizibile. În tumori, chromothripsis poate genera ADN extracromozomial (ecDNA) — fragmente circulare care transportă gene, pot amplifica oncogene și pot favoriza rezistența la terapii.
Cum inițiază N4BP2 reacția în lanț
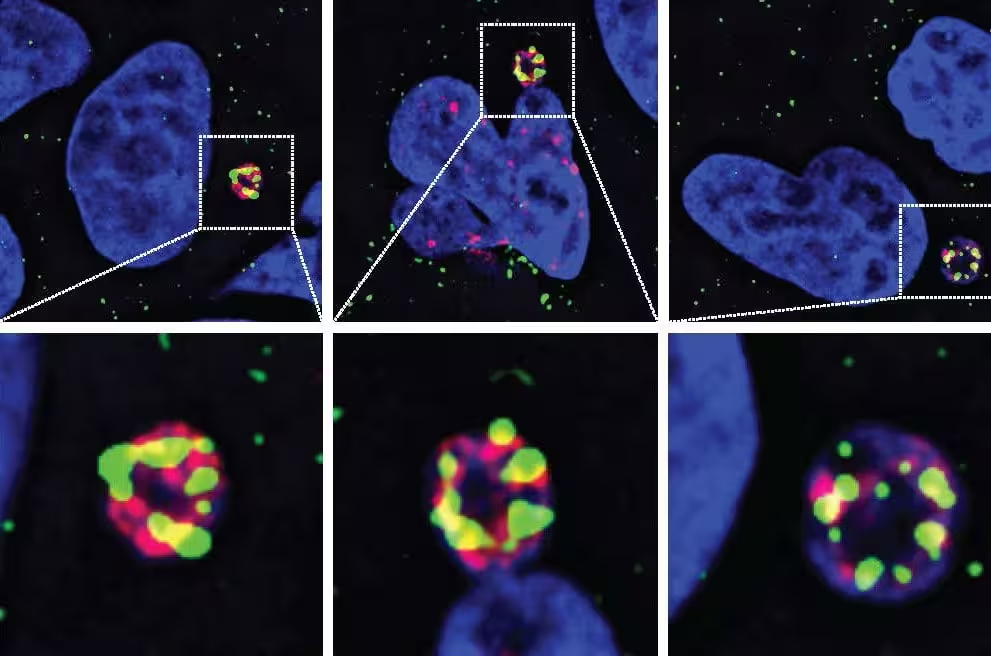
Erorile în timpul diviziunii celulare pot lăsa un cromozom întreg capturat într-un micronucleu mic și instabil. Când micronucleul se rupe, cromozomul blocat devine expus la nucleaze. Deși există multe nucleaze în celule, echipa UC San Diego a demonstrat că N4BP2 are capacitatea distinctă de a pătrunde în micronuclee și de a cataliza fragmentarea ADN-ului, declanșând astfel chromothripsis.
Observații experimentale cheie includ:
- Cribele bazate pe imagistică au localizat N4BP2 în micronuclee unde se acumulează leziuni ale ADN-ului.
- Ștergerea genetică a N4BP2 în celule de tumori cerebrale a redus semnificativ fragmentarea cromozomială.
- Direcționarea artificială a N4BP2 în nuclee intacte a produs rupturi de ADN, demonstrând suficiența activității enzimei, nu doar corelația.
"Această enzimă este scânteia care lipsea — odată identificată, mecanismul chromothripsis devine abordabil," a declarat Don Cleveland, Ph.D., autor principal al studiului.
La nivel molecular, N4BP2 pare să funcționeze atât ca endonuclează, cât și să interacționeze cu factori de recunoaștere a ADN-ului deteriorat. Datele sugerează că accesul la cromozomii izolați în micronuclee este un factor limitator: în condiții fiziologice, barierele structurale împiedică enzimele citoplasmatice să atingă materialul genetic; ruperea micronucleului schimbă această dinamică. Astfel, N4BP2 acționează într-un context spațial specific, transformând un eveniment relativ frecvent (formarea micronucleelor) într-un dezastru genomic punctual.
Detalii tehnice și relevanță experimentală
Metodele utilizate în studiu includ tijele de imagistică cu microscopie cu fluorescentă în timp real, secvențierea genomică de înaltă performanță pentru a cartografia rearanjamentele și ecranele CRISPR pentru a evalua necesitatea genelor candidate. Combinația acestor abordări conferă robustețe concluziilor: imagistica oferă dovezi spațiale, iar analiza genomică cuantifică extinderea rearanjamentelor și a ecDNA-ului. Din perspectivă științifică, astfel de date multi-omice sunt esențiale pentru a susține un model mecanic coerent.
În plus, studiile complementare au testat conservarea fenomenului în mai multe tipuri de celule tumorale și în linii celulare de origine diferită, demonstrând că activitatea N4BP2 este relevantă din punct de vedere biologic, nu doar un artefact al unei singure linii celulare.
Implicații clinice: un nou țintă pentru tumorile agresive și rezistente
Analiza a peste 10.000 de genomuri canceroase a legat expresia crescută a N4BP2 de frecvența mai mare a chromothripsis, de rearanjamente structurale complexe și de niveluri ridicate de ecDNA. Tumorile bogate în ecDNA se numără printre cele mai rezistente la tratament, iar studiul repoziționează ecDNA ca o consecință downstream a fenomenului mai amplu al chromothripsis. Prin plasarea N4BP2 la începutul acestei cascade, cercetătorii au identificat un posibil punct molecular de intervenție pentru reducerea instabilității genomice și încetinirea adaptării tumorale.
A reprezentat un pas important faptul că asocierea dintre N4BP2 și chromothripsis se vede atât în seturi mari de date clinice, cât și în experimente controlate în laborator. Această corelație susținută de dovezi experimentale sporește potențialul traducțional al descoperirii: nu este vorba doar de o observație moleculară, ci de o țintă măsurabilă în tumori.
Arii potențiale de transfer clinic includ:
- Dezvoltarea de mici molecule sau biologice care inhibă activitatea N4BP2 sau îi blochează localizarea la micronuclee.
- Teste diagnostice pentru măsurarea nivelurilor de N4BP2 ca biomarker al tumorilor predispuse la chromothripsis.
- Strategii combinate care asociază inhibitori N4BP2 cu terapii existente pentru a împiedica apariția rapidă a clonelor rezistente.
Provocări în dezvoltarea terapiei
Obținerea unor inhibitori specifici și siguri pentru N4BP2 ridică mai multe provocări: selectivitatea enzimei, toxicitatea pe țesuturi normale, și capacitatea de a penetra tumora. În plus, deoarece chromothripsis apare episodic și este asociat cu evenimente rare dar devastatoare, designul clinic trebuie să țină cont de selectarea pacienților care ar beneficia cel mai mult de pe urma unei intervenții — de exemplu, cei cu semnături genomice evidente de ecDNA sau nivele crescute de N4BP2.
Validarea preclinică va necesita modele animale adecvate care reproduc formarea micronucleelor și generarea ecDNA, precum și studii toxico‑farmacologice pentru a evalua efectele inhibării N4BP2 asupra organismului gazdă. În etapele ulterioare, biomarkeri predictivi și teste funcționale ar putea fi integrate în protocoalele de includere ale studiilor clinice.
De la laborator la drum: analogii auto și perspectivă practică
Entuziaștii auto evaluează adesea un vehicul după motor, șasiu și diagnoză — aceeași lentilă ajută la conceptualizarea comportamentului tumorii. N4BP2 funcționează asemănător unei unități de control defecte (ECU) care declanșează o cascadă, determinând cedarea simultană a componentelor critice, nu pe rând. La fel cum producătorii folosesc diagnosticare la bord pentru a detecta și izola defecțiunile devreme, oncologia ar putea avea acum un indicator molecular pentru a semnaliza cancerele pregătite să treacă prin „catastrofe genomice”.
Pentru cititorii urmărind tendințele auto, această descoperire seamănă cu introducerea unui senzor de diagnoză care schimbă strategiile de întreținere: detectarea timpurie a defecțiunii previne o avarie totală. În oncologie, țintirea N4BP2 ar putea reduce șansa ca o tumoră să se reconfigureze brusc într‑una mai agresivă și rezistentă la tratament — analog unei avarii catastrofale a motorului care te lasă blocat pe marginea drumului.
Impact asupra industriei și cercetării
Dincolo de interesul academic, descoperirea are implicații pentru dezvoltarea clinică și modul în care cercetătorii prioritizează țintele terapeutice. ecDNA — acum legat de chromothripsis prin N4BP2 — devine un punct de interes major în cercetarea cancerului, atrăgând atenția unor organisme de finanțare influente. Limitarea sursei de formare a ecDNA ar putea modifica cererea pe piață pentru diagnostice și terapii îndreptate împotriva cancerelor greu de tratat, precum glioblastomul și osteosarcomul.
Pentru investitorii biotech și strategiile farmaceutice, această descoperire oferă un profil de țintă mai clar: o enzimă suficientă pentru a provoca evenimente genomice catastrofale și măsurabilă în mii de genomuri tumorale. Această combinație de „suficiență” experimentală și validare clinică potențială mărește atractivitatea dezvoltării unui program terapeutic concentrat pe N4BP2.
Aspecte economice și prioritizarea resurselor
Pe termen lung, dacă inhibiția N4BP2 se dovedește eficientă în reducerea apariției ecDNA și a adaptării tumorale, companiile de diagnostic vor dezvolta teste moleculare pentru detectarea nivelurilor de N4BP2 sau a semnăturilor de chromothripsis. În paralel, firmele farmaceutice ar putea integra astfel de diagnostice în strategii de oncologie de precizie, direcționând tratamente către pacienți cu risc ridicat de evenimente genomice catastrofale.
Concluzii și puncte cheie pentru publicul larg și pasionații de auto
- N4BP2 este enzima identificată ca putând declanșa chromothripsis, o formă rapidă și devastatoare de rearanjare genomică.
- Tumorile cu expresie crescută a N4BP2 prezintă mai mult chromothripsis și nivele ridicate de ecDNA, factori asociați cu rezistența la tratament.
- Terapia sau diagnosticele care vizează N4BP2 ar putea stabiliza genomul tumoral — similar întreținerii preventive care oprește o cascadă mecanică înainte de un avarie totală.
Ca în cazul oricărei descoperiri majore, traducerea acestei cunoașteri în tratamente sigure și eficiente va necesita timp, resurse și validare clinică riguroasă. Totuși, identificarea „scânteii” moleculare schimbă modul în care oamenii de știință abordează instabilitatea genomică și oferă un punct de plecare concret pentru noi strategii anti‑cancer.
Pentru pasionații de inginerie auto care apreciază precizia: imaginați‑vă un viitor în care medicii pot diagnostica și neutraliza componenta care provoacă o avarie catastrofală. Aceasta este promisiunea pe care descoperirea de la UC San Diego o aduce în lupta împotriva celor mai agresive tipuri de cancer.
Sursa: scitechdaily

Lasă un Comentariu